산소와 산화 환원 반응
(1) 산소의 이동에 의한 산화 환원
① 산화:산소를 얻는 반응이다.
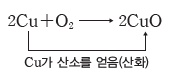
② 환원:산소를 잃는 반응이다.
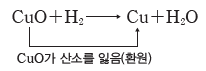
③ 산화 환원의 동시성:한 물질이 산소를 얻을 때 다른 물질이 그 산소를 잃으므로, 산화와 환원은 항상 동시에 일어난다.

(2) 산소의 이동에 의한 여러 가지 산화 환원 반응
① 연소:물질이 산소와 빠르게 반응하면서 빛과 열을 내는 현상으로, 산화 환원 반응에 속한다.
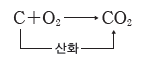
- 숯의 연소:숯은 주로 탄소(C)로 이루어진 물질이며, 완전 연소되는 과정에서 탄소가 산소와 결합하여 이산화 탄소가 생성된다.
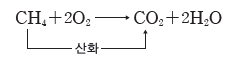
- 천연 가스의 연소:천연 가스의 주성분은 메테인(CH4)으로, 메테인이 완전 연소되면 이산화 탄소와 물이 생성된다. 이때 메테인에 포함된 탄소가 산소와 결합하면서 산화된다.
② 철의 제련
- 산화 철(Fe2O3)이 주성분인 철광석에서 순수한 철(Fe)을 얻는 방법으로, 산화 철(Fe2O3)이 철(Fe)로 환원된다.
- 용광로에 철광석과 탄소(C)가 주성분인 코크스를 넣고 뜨거운 공기를 불어넣으면 탄소(C)가 불완전 연소되어 일산화 탄소(CO)가 되고, CO에 의해 Fe2O3이 산소를 잃고 환원되어 Fe이 된다.
전자와 산화 환원 반응
(1) 전자의 이동에 의한 산화 환원
① 산화:전자를 잃는 반응이다. Zn → Zn2++2e–
② 환원:전자를 얻는 반응이다. Cu2++2e– → Cu
③ 산화 환원의 동시성
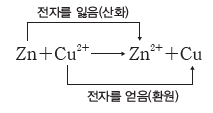
- 한 물질이 전자를 잃고 산화될 때 다른 물질이 그 전자를 얻어서 환원되므로, 산화와 환원은 항상 동시에 일어난다.
- 산화되는 물질이 잃은 전자 수와 환원되는 물질이 얻은 전자 수는 같다.

(2) 전자의 이동에 의한 여러 가지 산화 환원 반응
① 금속과 비금속의 반응:금속은 산화되어 양이온이 되고, 비금속은 환원되어 음이온이 된다.
- 나트륨과 염소의 반응:나트륨(Na)을 염소(Cl2) 기체가 들어 있는 용기에 넣고 반응시키면 불꽃을 내며 격렬히 반응한다. 금속인 나트륨은 전자를 잃고 산화되어 양이온이 되고, 비금속인 염소는 전자를 얻고 환원되어 음이온이 되므로 이온 결합 물질인 염화 나트륨(NaCl)이 생성된다.

- 마그네슘과 산소의 반응:공기 중에서 마그네슘(Mg) 리본에 불을 붙이면 격렬히 연소된다. 금속인 마그네슘은 전자를 잃고 산화되어 양이온이 되고, 비금속인 산소는 전자를 얻고 환원되어 음이온이 되므로 이온 결합 물질인 산화 마그네슘(MgO)이 생성된다.

② 금속과 금속 이온의 반응
- 반응성이 작은 금속의 양이온이 들어 있는 수용액에 반응성이 큰 금속을 넣으면, 반응성이큰 금속은 산화되어 양이온으로 수용액에 녹아 들어가고, 반응성이 작은 금속의 양이온은 환원되어 금속으로 석출된다.
- 반응성이 큰 금속의 양이온이 들어 있는 수용액에 반응성이 작은 금속을 넣으면 반응이 일어나지 않는다.
③ 금속과 산의 반응:산 수용액에 수소보다 반응성이 큰 금속을 넣으면 금속은 산화되어 양이온이 되고, H+이 환원되어 수소 기체가 발생한다.
- 마그네슘을 묽은 염산에 넣으면 마그네슘 표면에서 수소 기체가 발생한다. 마그네슘은 전자를 잃고 산화되어 양이온이 되고, H+은 전자를 얻고 환원되어 수소 기체가 발생한다. 단, 수소(H)보다 반응성이 작은 금(Au), 백금(Pt), 은(Ag), 수은(Hg), 구리(Cu)는 수소 이온과 반응하지 않는다.

④ 할로젠과 할로젠화 이온의 반응:할로젠 원소의 반응성은 F2>Cl2>Br2>I2으로, 반응성이 작은 할로젠의 음이온이 들어 있는 수용액에 반응성이 큰 할로젠 분자를 넣으면 반응성이 작은 할로젠의 음이온은 산화되어 할로젠 분자가 되고, 반응성이 큰 할로젠 분자는 환원되어 음이온이 되는 산화 환원 반응이 일어난다.
예) 무색의 브로민화 칼륨(KBr) 수용액에 염소(Cl2)를 넣으면 브로민화 이온(Br–)은 전자를 잃고 산화되어 적갈색의 브로민(Br2)이 되고, 염소(Cl2)는 전자를 얻고 환원되어 염화 이온(Cl–)이 된다.

산화수와 산화 환원
(1) 산화수:산화수는 물질을 구성하는 원자가 산화되거나 환원된 정도를 나타내기 위한 값으로, 산소가 관여하거나 전자의 이동이 분명한 반응에서부터 전자가 원자 사이에 공유되어 공유 결합 물질이 생성되는 반응에 이르기까지 여러 가지 산화 환원 반응을 모두 설명하기 위해 산화수를 사용한다.
① 이온 결합 물질에서의 산화수:양이온과 음이온이 결합된 이온 결합 물질에서 양이온은 원자가 전자를 잃고, 음이온은 원자가 전자를 얻어 형성된 것으로, 각 이온의 전하가 그 이온의 산화수이다.
예) NaCl:Na+과 Cl–으로 이루어져 있다. ⇨ Na의 산화수:+1, Cl의 산화수:-1
MgO:Mg2+과 O2-으로 이루어져 있다. ⇨ Mg의 산화수:+2, O의 산화수:-2
② 공유 결합 물질에서의 산화수:전기 음성도가 큰 원자가 공유 전자쌍을 모두 가진다고 가정할 때, 각 구성 원자의 전하가 그 원자의 산화수이다.
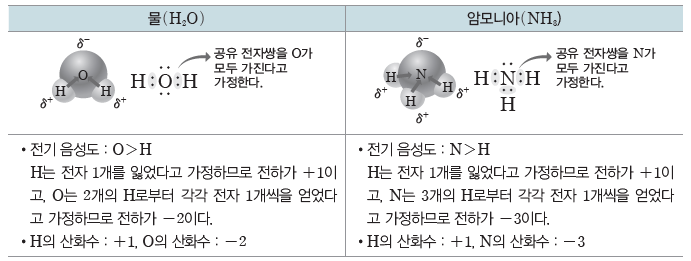
(2) 산화수 규칙:원자들의 전기 음성도를 토대로 산화수를 구할 수 있는데, 몇몇 원자들은 여러 화합물 내에서 일정한 산화수를 나타낸다. 이를 이용하여 산화수를 쉽게 구하기 위한 방법이 산화수 규칙이다.
(3) 산화수의 주기성
① 화합물을 형성할 때 화합물을 이루고 있는 각 원자들은 비활성 기체와 같은 전자 배치를 이루려는 경향(옥텟 규칙)이 있다. 산화수는 원자가 전자를 잃거나 얻으려는 성질과 관련되어 있으므로 원자의 전자 배치와 관계있으며 주기성을 나타낸다.
② 어떤 원자에 결합된 상대 원자의 전기 음성도에 따라 그 원자가 전자를 잃거나 얻을 수 있기 때문에 같은 원자라도 화합물에 따라서 여러 가지 산화수를 가질 수 있다.
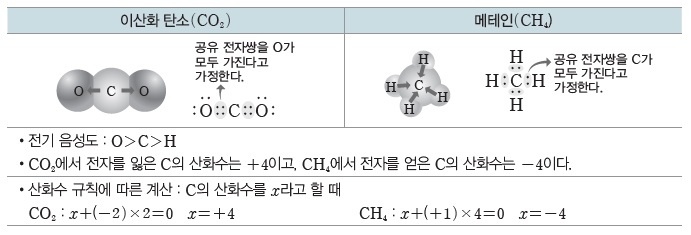
(4) 산화수와 산화 환원
① 산화:산화수가 증가하는 반응이다.
⇨ 원자가 전자를 잃으면 산화수는 ‘+’값이 되므로 산화수가 증가하는 것은 전자를 잃는 것과 같아서 산화에 해당한다.
② 환원:산화수가 감소하는 반응이다.
⇨ 원자가 전자를 얻으면 산화수는 ‘-’값이 되므로 산화수가 감소하는 것은 전자를 얻는 것과 같아서 환원에 해당한다.
③ 산화 환원의 동시성
- 산화 환원 반응에서 한 원자의 산화수가 증가하면 다른 원자의 산화수가 감소하므로, 산화와 환원은 항상 동시에 일어난다.
- 산화되는 물질에서 증가한 산화수의 합은 환원되는 물질에서 감소한 산화수의 합과 같다.
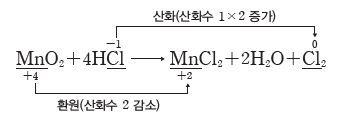
④ 산화 환원 반응 여부의 판단:화학 반응 전과 후에 산화수가 변하는 원자가 있으면 산화 환원 반응이고, 산화수가 변하는 원자가 없으면 산화 환원 반응이 아니다.
산화 환원 반응식
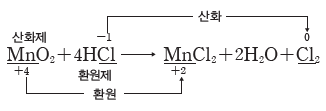
(1) 산화제와 환원제
① 산화제:다른 물질을 산화시키고 자신은 환원되는 물질이다.
② 환원제:다른 물질을 환원시키고 자신은 산화되는 물질이다.
(2) 산화제와 환원제의 상대적 세기
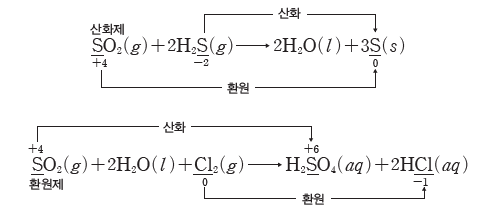
같은 물질이라고 해도 어떤 물질과 반응하는가에 따라 산화되기도 하고 환원되기도 한다. 산화 환원 반응에서 전자를 잃거나 얻으려는 경향은 서로 상대적이므로 어떤 반응에서 산화제로 작용하는 물질이 다른 물질과 반응할 때는 환원제로 작용할 수도 있다.
예) 이산화 황(SO2)이 황화 수소(H2S)와 반응할 때에는 SO2이 환원되면서 H2S를 산화시키는 산화제로 작용하고, 이산화 황(SO2)이 상대적으로 더 강한 산화제인 염소(Cl2)와 반응할 때에는 SO2이 산화되면서 Cl2를 환원시키는 환원제로 작용한다.
(3) 산화 환원 반응식의 완성
산화 환원 반응에서 증가한 산화수의 합과 감소한 산화수의 합은 항상 같으므로 반응물과 생성물의 원자 수와 산화수 변화를 맞추어 화학 반응식을 완성할 수 있다.
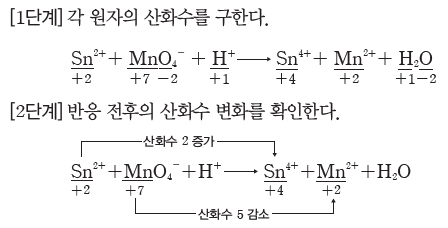
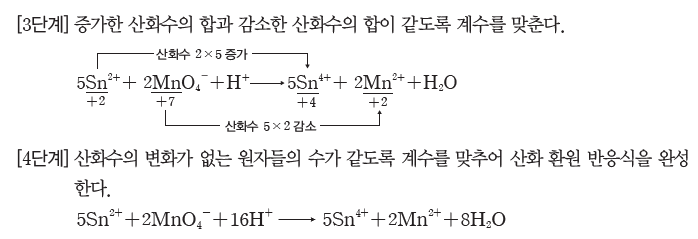
예) Sn2++MnO4-+H+ → Sn4++Mn2++H2O의 화학 반응식 완성하기
(4) 산화 환원 반응의 양적 관계
화학 반응식에서 계수비는 반응 몰비이므로 산화 환원 반응식을 완성하면 반응하는 산화제와 환원제의 양적 관계를 구할 수 있다.
예) 산화 철(Fe2O3)과 일산화 탄소(CO)가 반응하여 철과 이산화 탄소가 생성되는 반응의 완성된 화학 반응식은 Fe2O3(s)+3CO(g) → 2Fe(s)+3CO2(g)로, 산화제인 Fe2O3과 환원제인 CO가 1 : 3의 몰비로 반응하므로 Fe2O3 1 mol이 환원될 때 CO 3 mol이 산화된다.
화학 반응에서 출입하는 열
(1) 화학 반응과 열의 출입
화학 반응에서 반응물과 생성물이 가지고 있는 에너지가 다르기 때문에 화학 반응이 일어날 때 열의 출입이 있게 된다.
(2) 발열 반응과 흡열 반응
① 발열 반응
- 화학 반응이 일어날 때 열을 방출하는 반응이다.
- 생성물의 에너지 합이 반응물의 에너지 합보다 작으므로 반응하면서 열을 방출한다.
- 열을 방출하므로 주위의 온도가 높아진다.
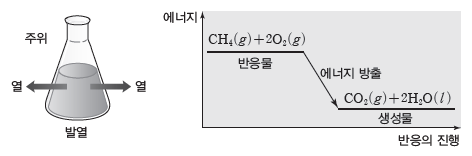
예) 메테인(CH4)이 완전 연소되면 이산화 탄소와 물이 생성되는데, 이 반응은 열을 방출하는 발열 반응이다.
② 흡열 반응
- 화학 반응이 일어날 때 열을 흡수하는 반응이다.
- 생성물의 에너지 합이 반응물의 에너지 합보다 크므로 반응하면서 열을 흡수한다.
- 열을 흡수하므로 주위의 온도가 낮아진다.
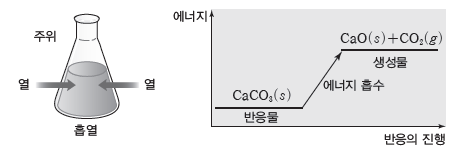
예) 탄산 칼슘(CaCO3)을 가열하면 분해되어 이산화 탄소가 발생하는데, 이 반응은 열을 흡수하는 흡열 반응이다.
③ 여러 가지 발열 반응과 흡열 반응

(3) 열량계를 이용한 열의 측정
① 화학 반응에서 출입하는 열의 양은 열량계를 사용하여 측정할 수 있다.
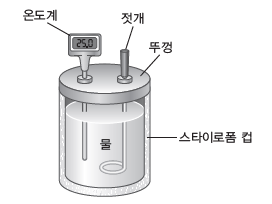
② 열량계와 외부 사이에 열의 출입이 없다고 가정하고 열량계 자체가 흡수하는 열을 무시하면 화학 반응에서 발생한 열량은 열량계 속 용액이 얻은 열량과 같다.

참고자료: EBS 수능 특강 화학1