산과 염기의 정의
(1) 아레니우스 정의
① 아레니우스 정의:산과 염기가 물에 녹아서 이온화하는 것을 근거로 한 정의이다.
- 산:수용액에서 수소 이온(H+)을 내놓는 물질
예) HBr, HF, HNO3, H2SO4 등
HCl(aq) → H+(aq)+Cl–(aq)
CH3COOH(aq) → H+(aq)+CH3COO–(aq)
- 염기:수용액에서 수산화 이온(OH-)을 내놓는 물질
예) LiOH, KOH, Ba(OH)2 등
NaOH(aq) → Na+(aq)+OH-(aq)
Ca(OH)2(aq) → Ca2+(aq)+2OH–(aq)
② 아레니우스 산 염기 정의의 한계:H+을 내놓지 않는 산 또는 OH–을 내놓지 않는 염기는 설명할 수 없고, 수용액 상태가 아닌 경우에도 적용할 수 없다.
(2) 브뢴스테드·로리 정의
① 브뢴스테드·로리 정의:아레니우스 정의보다 확장된 개념이다.
- 산:양성자(H+)를 주는 물질 ⇨ 양성자 주개
- 염기:양성자(H+)를 받는 물질 ⇨ 양성자 받개
② HCl 수용액에서 브뢴스테드·로리 산과 염기
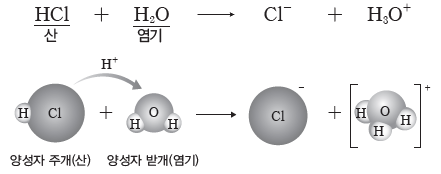
- HCl는 H2O에게 양성자(H+)를 주므로 브뢴스테드·로리 산이고, H2O은 HCl로부터 양성자(H+)를 받으므로 브뢴스테드·로리 염기이다.
③ NH3 수용액에서 브뢴스테드·로리 산과 염기
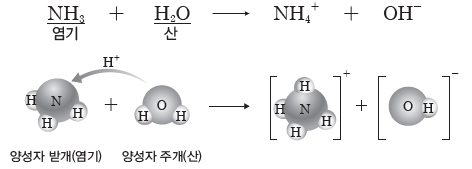
H2O은 NH3에게 양성자(H+)를 주므로 브뢴스테드·로리 산이고, NH3는 H2O로부터 양성자(H+)를 받으므로 브뢴스테드·로리 염기이다.
중화 반응
(1) 중화 반응
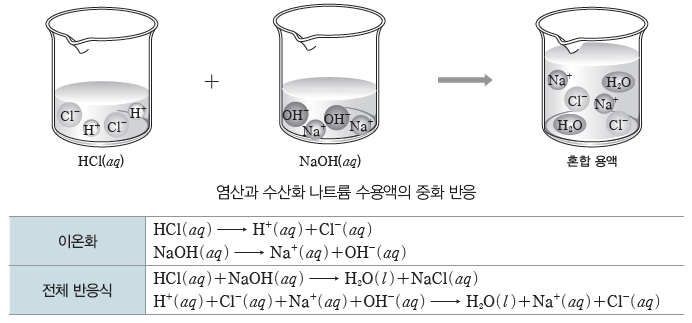
① 중화 반응은 수용액에서 산과 염기가 반응하여 물이 생성되는 반응이다.
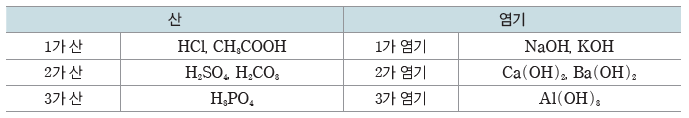
② 염화 수소(HCl)와 수산화 나트륨(NaOH)은 각각의 수용액에서 이온화하여 양이온과 음이온으로 존재하고, 두 수용액을 혼합하면 수소 이온(H+)과 수산화 이온(OH–)이 반응하여 물(H2O)이 된다.
(2) 중화 반응의 알짜 이온 반응식
① 구경꾼 이온:화학 반응에서 반응에 참여하지 않고 반응 후에도 용액에 그대로 남아 있는 이온을 말한다. HCl(aq)과 NaOH(aq)의 반응에서 Na+과 Cl–의 수는 반응 전과 후에 아무런 변화가 없으므로 Na+과 Cl–은 구경꾼 이온이다.
② 알짜 이온 반응식:화학 반응에서 구경꾼 이온을 제외하고 실제 반응에 참여한 이온으로만나타낸 반응식이다. H+과 OH–이 반응하여 물을 생성하는 중화 반응의 알짜 이온 반응식은다음과 같다.
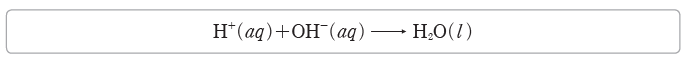
중화 반응에서의 양적 관계
(1) 중화 반응에서의 이온 수
① 산과 염기 수용액을 혼합하면 H+과 OH–이 1 : 1의 몰비로 반응하여 물이 된다.
H+(aq)+OH–(aq) → H2O(l)
② 일반적으로 중화 반응의 양적 관계를 다룰 때 물의 자동 이온화는 고려하지 않는다. 산의 H+과 염기의 OH–의 양에 비해 물의 자동 이온화에 의한 H+과 OH–의 양은 무시할 정도로 적기 때문이다.
③ 산과 염기의 중화 반응에서 산과 염기 수용액에 있는 H+과 OH– 중 중화 반응하고 남은 이온의 종류에 의해 혼합 용액의 액성이 결정된다.
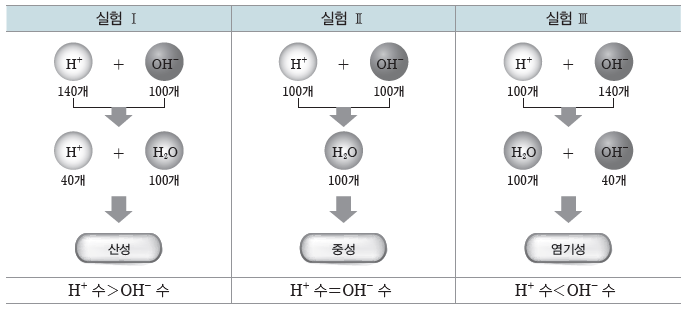
④ 혼합 용액의 액성:일정한 양의 HCl(aq)에 NaOH(aq)을 조금씩 가할 경우, 넣어 준NaOH(aq)의 양에 따라 혼합 용액의 액성이 달라진다.
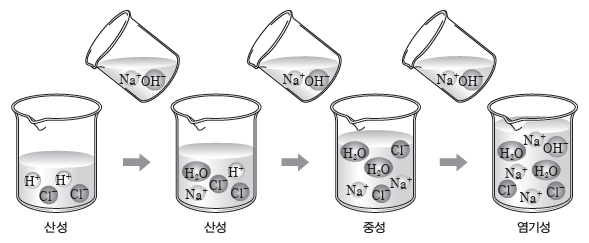
⑤ 중화 반응에서의 이온 수 변화:중화 반응은 H+과 OH–이 반응하여 물을 생성하는 반응으로 산 용액에 염기 용액을 가하거나 염기 용액에 산 용액을 가하여 반응시킬 때 이온 수의 변화가 생긴다.
- HCl(aq)이 들어 있는 비커에 NaOH(aq)을 가하여 반응시킬 때 Na+과 Cl–은 구경꾼 이온이므로 비커에 들어 있던 Cl– 수는 일정하게 유지되지만 가하는 용액에 들어 있는 Na+ 수는 계속 증가한다.
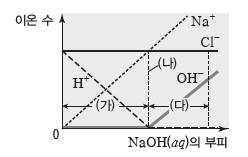
- (가) 구간은 비커에 있던 H+이 가해 준 OH–과 반응하여 H+ 수가 감소하는 구간으로 반응
하여 없어지는 H+ 수만큼 Na+이 가해지기 때문에 전체 이온 수는 일정하게 유지된다.
- (나)는 비커에 들어 있던 H+과 같은 수의 OH–을 가한 지점으로 모든 H+과 OH–이 반응하
여 물이 된 지점이다. 이때 H+과 같은 수의 OH–이 공급되었으므로 Cl– 수와 Na+ 수는 같다.
- (다) 구간은 H+이 모두 반응하였고, 계속하여 OH–이 가해지는 구간으로 더 이상 반응이 일어나지 않으므로 Na+ 수, OH– 수, 전체 이온 수는 계속 증가한다.
- 혼합 용액의 액성은 (가) 구간에서 산성, (나)에서 중성, (다) 구간에서 염기성이다.
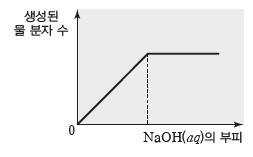
⑥ 중화 반응으로 생성되는 물 분자 수:HCl(aq)이 들어 있는 비커에 NaOH(aq)을 가하면H+(aq)+OH–(aq) → H2O(l)의 중화 반응이 일어나므로 물이 생성된다. H+이 존재하는 동안에는 가하는 NaOH(aq)의 부피에 비례하여 생성된 물 분자 수도 증가한다. 이때 중화 반응하는 H+ 수와 OH– 수, 생성된 물 분자 수의 비는 1:1:1이다. 그러나 완전히 중화된 이후에는 H+이 더 이상 용액 속에 존재하지 않으므로 NaOH(aq)을 더 가하더라도 생성된 물 분자 수의 변화는 없다.
(2) 중화 반응에서의 양적 관계
① H+과 OH–의 양적 관계:H+과 OH–은 1 : 1의 몰비로 반응한다.
⇨ 반응한 산이 내놓는 H+의 양(mol)과 반응한 염기가 내놓는 OH–의 양(mol)은 같다.
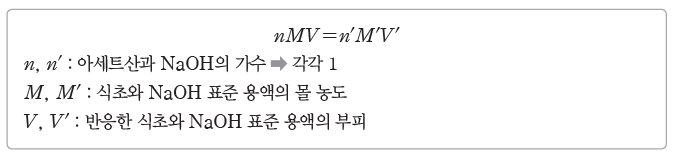
② 반응한 산과 염기의 가수, 용액의 몰 농도, 부피의 관계

- 산과 염기의 가수:산 또는 염기 1 mol이 최대로 내놓을 수 있는 H+ 또는 OH–의 양(mol)에 해당하는 수이다.
- 반응한 산 또는 염기 수용액의 몰 농도(M)와 부피(L)의 곱은 반응한 산 또는 염기의 양(mol)이다(MV, M’V’).
- 반응한 산 또는 염기의 가수, 수용액의 몰 농도(M), 부피(L)의 곱은 반응한 산 또는 염기가 내놓는 H+ 또는 OH–의 양(mol)이다(nMV, n’M’V’).
- 반응한 산이 내놓는 H+의 양(mol)과 반응한 염기가 내놓는 OH–의 양(mol)은 같으므로 nMV=n’M’V’이다.
③ 중화 반응에서의 양적 관계(nMV=n’M’V’)
예) 1 M H2SO4(aq) 100 mL에 들어 있는 H2SO4과 0.5 M NaOH(aq) 400 mL에 들어있는 NaOH이 모두 반응한 경우
- 화학 반응식:H2SO4(aq)+2NaOH(aq) ⇨ 2H2O(l)+Na2SO4(aq)
- 양적 관계 해석

⇨ 반응한 H2SO4이 내놓는 H+의 양과 반응한 NaOH이 내놓는 OH–의 양은 0.2 mol로 서로 같다.
중화 적정
(1) 중화 적정:농도를 모르는 산이나 염기의 농도를 중화 반응의 양적 관계(nMV=n’M’V’)를 이용하여 알아내는 실험 방법이다. 이때 농도를 정확히 알고 있는 염기나 산 수용액이 사용되는데 이를 표준 용액이라고 한다.
① 중화점:중화 적정에서 반응한 산의 H+의 양(mol)과 반응한 염기의 OH–의 양(mol)이 같아져 산과 염기가 완전히 중화되는 점을 중화점이라고 한다.
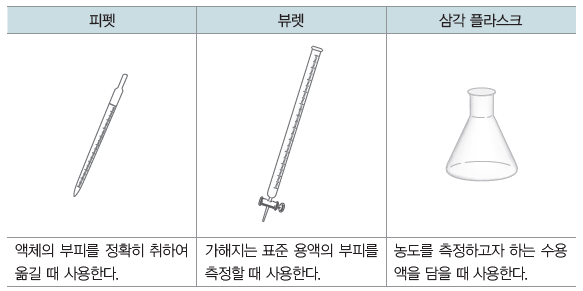
② 중화 적정에 사용되는 실험 기구
(2) 중화 적정을 이용한 식초 속 아세트산 함량 구하기 실험 계획
① 화학 반응식을 작성한다.
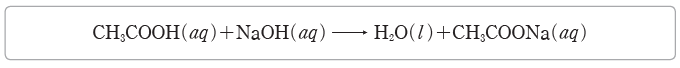
② 식초 속 아세트산 함량을 구하기 위해 중화 적정의 양적 관계를 이해한다.
- nMV=n’M’V’의 관계를 이용한다.
- 계산된 식초의 몰 농도를 이용하여 식초 속 아세트산의 함량(%)을 계산한다(단, 식초의 밀도를 1 g/mL로 가정한다).
③ 실험 조건을 결정한다.
- 필요할 경우 임의의 조건으로 간단히 예비 실험을 실시한다.
- 표준 용액과 지시약의 종류를 결정한다.
예) 표준 용액:NaOH(aq), 지시약 : 페놀프탈레인 용액(산성에서 무색, 염기성에서 붉은색)
- 식초의 희석 비율과 표준 용액의 농도를 결정한다.
- 실험 기구 종류 및 크기와 사용할 시약의 양을 결정한다.
④ 준비물을 확인한다.
- 시약:식초, NaOH 표준 용액, 페놀프탈레인 용액, 증류수 등
- 실험 도구 : 비커, 피펫, 피펫 필러, 삼각 플라스크, 스포이트, 뷰렛, 뷰렛 집게, 스탠드, 깔때기, 실험복, 실험용 장갑, 보안경 등(지시약의 혼합을 위해 유리 막대, 자석 젓개와 자석교반기 등을 사용할 수 있다.)
⑤ 자세한 실험 과정을 설계한다.
⑥ 실험 중 유의할 점을 확인한다.
- 아세트산은 휘발성이 크기 때문에 식초의 뚜껑을 잘 닫아두어야 하고, 실험에 걸리는 시간을 가능한 한 짧게 하여 공기 중으로 날아가는 아세트산의 양을 최소화해야 한다.
- 표준 용액이 식초보다 농도가 너무 크면 정확한 중화점을 찾기가 어렵고, 표준 용액이 식초보다 농도가 너무 작으면 넣어 주어야 할 표준 용액의 양이 너무 커서 실험이 어려워진다(일반적으로 시판되고 있는 식초에 대해 0.1 M NaOH 표준 용액을 사용할 경우 식초의 농도를 약 1/10배로 묽히는 것이 적당하다).
- 뷰렛에 표준 용액을 넣은 후 일정량을 흘려주어 뷰렛 꼭지의 아랫부분을 표준 용액으로 채운 후에 표준 용액의 처음 부피를 측정해야 한다.
(3) 식초 속 아세트산 함량 구하기 실험 수행
① 피펫으로 식초 3 mL를 취하여 삼각 플라스크에 넣고 증류수를 넣어 약 30 mL가 되게 한후 페놀프탈레인 용액을 2~3방울 떨어뜨린다.
② 깔때기를 이용해 뷰렛에 0.1 M NaOH 표준 용액을 넣고 꼭지를 잠시 열었다가 닫아 표준
용액을 조금 흘려준다.
③ 뷰렛에 표준 용액을 채운 후 뷰렛의 눈금을 읽는다.
④ 그림과 같이 장치한 후 뷰렛 꼭지를 열어 0.1 M NaOH 표준 용액을 희석된 식초가 든 삼각 플라스크에 조금씩 떨어뜨린다.
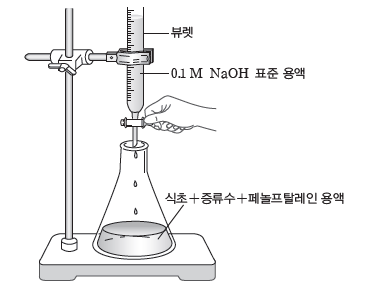
⑤ 붉은색이 나타나면 삼각 플라스크를 흔들어 주면서 한 방울씩 떨어뜨리고 붉은색이 사라지지 않을 때 꼭지를 잠근 후 뷰렛의 눈금을 읽는다.
⇨ 식초 3 mL를 완전히 중화시키는 데 필요한 0.1 M NaOH 표준 용액의 부피(③과 ⑤에서 읽은 눈금의 차):30 mL
⑥ 반응한 CH3COOH이 내놓는 H+의 양(mol)과 반응한 NaOH이 내놓는 OH–의 양(mol)은 같으므로 식초의 몰 농도를 x M라고 하면, 1×x M×3 mL=1×0.1 M×30 mL에서 식초의 몰 농도는 1 M이다. 또한 식초의 몰 농도가 1 M이므로 식초 1 L에 아세트산이 1 mol 들어 있다. 식초의 밀도를 1 g/mL로 가정하면, 식초 1 L는 1000 g에 해당하고, 여기에 아세트산이 60 g(아세트산 1 mol의 질량) 들어 있다. 따라서 식초 속 아세트산의 함량은60 g/1000 g ×100=6%이다.
참고자료: EBS 수능 특강 화학1