가역 반응과 비가역 반응
(1) 정반응과 역반응
① 정반응은 반응물이 생성물로 되는 반응이고, 역반응은 정반응의 생성물이 다시 반응물로 되는 반응이다.
② 정반응과 역반응은 서로 반대 방향으로 진행하는 반응이다.
(2) 가역 반응
① 가역 반응:반응 조건(농도, 압력, 온도 등)에 따라 정반응과 역반응이 모두 일어날 수 있는 반응으로, 화학 반응식에서 ⇆로 나타낸다.

② 가역 반응의 예
- 물을 냉동실에 넣으면 얼음이 되지만 얼음을 밖에 꺼내 놓으면 다시 녹아 물이 된다. (정반응:물의 응고, 역반응:얼음의 융해)
- 이른 아침 공기 중 수증기가 풀잎에 이슬로 맺히지만 시간이 지나면서 다시 공기 중 수증기로 돌아가 이슬이 없어진다. (정반응:수증기의 액화, 역반응:물의 기화)
- 물에 이산화 탄소가 녹아 있는 탄산음료의 용기 뚜껑을 열어 두면 이산화 탄소가 다시 공기중으로 빠져나가 탄산음료의 톡 쏘는 맛이 약해진다. (정반응:이산화 탄소가 물에 녹는 반응, 역반응:이산화 탄소가 탄산음료에서 빠져나오는 반응)
(3) 비가역 반응
① 비가역 반응:한쪽 방향으로만 진행되는 반응으로, 역반응이 일어나지 않거나 정반응에 비해 무시할 수 있을 만큼 거의 일어나지 않는다.
② 비가역 반응의 예
- 연료의 연소:메테인 또는 에탄올을 완전 연소시키면 이산화 탄소와 물이 생성된다.
CH4(g)+2O2(g) → CO2(g)+2H2O(l)
C2H5OH(l)+3O2(g) → 2CO2(g)+3H2O(l)
- 금속과 산의 반응:마그네슘 리본을 염산에 넣으면 수소 기체가 발생한다.
Mg(s)+2HCl(aq) → H2(g)+MgCl2(aq)
- 중화 반응:염산에 수산화 나트륨 수용액을 넣으면 중화 반응이 일어난다.
HCl(aq)+NaOH(aq) → H2O(l)+NaCl(aq)
동적 평형
(1) 동적 평형
① 동적 평형:가역 반응에서 반응물과 생성물의 농도가 변하지 않는 경우 겉으로 보기에 반응이 일어나지 않는 것처럼 보이지만 실제로는 정반응과 역반응이 같은 속도로 일어나고 있는동적 평형 상태이다. 동적 평형 상태에서는 반응물과 생성물의 양이 일정하게 유지된다.
② 동적 평형의 예
- 밀폐된 용기 안에 충분한 시간 동안 물을 담아 두면 물이 증발하는 속도와 수증기가 응축하는 속도가 같은 동적 평형에 도달하고, 물과 수증기의 양은 일정하게 유지된다.
H2O(l) ⇆ H2O(g)
- 충분한 양의 설탕(C12H22O11)을 충분한 시간 동안 물에 넣어 두면 설탕이 용해되는 속도와 석출되는 속도가 같은 동적 평형에 도달하게 되고, 수용액에서 설탕의 농도는 일정하게 유지된다.
C12H22O11(s) ⇆C12H22O11(aq)
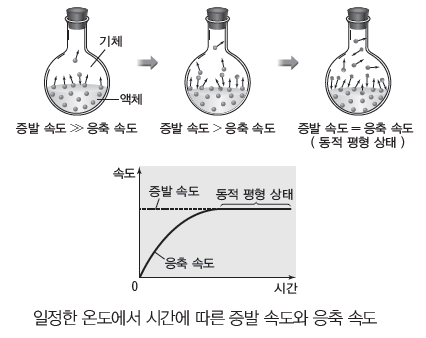
(2) 상평형
① 2가지 이상의 상태가 공존할 때 서로 상태가 변하는 속도가 같아서 겉보기에 상태 변화가 일어나지 않는 것처럼 보이는 동적 평형 상태에 도달하게 되는데, 이를 상평형이라고 한다.
② 액체와 기체 사이의 상평형은 일정한 온도에서 밀폐된 용기에 들어 있는 액체가 액체 표면에서 기체로 되는 증발 속도와 기체가 액체로 되는 응축 속도가 같아져서 변화가 없는 것처럼
보이는 상태이다. 밀폐된 진공 용기에 액체를 넣었을 때 초기에는 증발 속도가 응축 속도보다 크지만 시간이 지나면서 응축 속도가 점점 커져 증발 속도와 같아지는 동적 평형 상태에 도달한다. 동적 평형 상태에서는 기체의 양과 액체의 양이 일정하게 유지된다.
③ 고체와 액체 사이의 상평형, 고체와 기체 사이의 상평형도 있다.
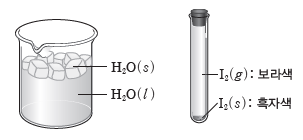
예) 얼음과 물 사이의 상평형, 승화성이 있는 아이오딘 고체와 기체 사이의 상평형
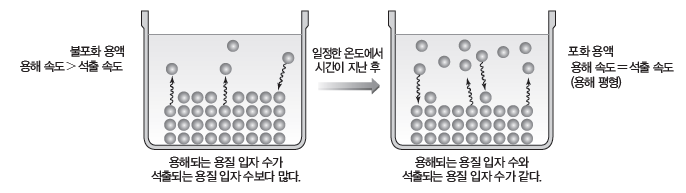
(3) 용해 평형
① 용매 속에 충분한 양의 고체 용질이 충분한 시간 동안 들어 있을 때 용질이 용해되는 속도와 석출되는 속도가 같아서 겉보기에 용해나 석출이 일어나지 않는 것처럼 보이는 동적 평형 상태에 도달하는데, 이를 용해 평형이라고 한다.
② 고체 용질과 액체 용매 사이의 용해 평형은 일정한 온도에서 고체 용질이 액체 용매에 녹을 때 용질이 용매에 녹는 용해 속도와 용매에 녹아 있던 용질이 다시 고체 용질로 되돌아가는 석출 속도가 같아져서 변화가 없는 것처럼 보이는 상태이다. 초기에는 용해 속도가 석출 속도보다 크지만 시간이 지나면서 석출 속도가 점점 커져 용해 속도와 같아지는 동적 평형에도달한다. 동적 평형 상태에서는 고체 용질의 양과 용액의 농도가 일정하게 유지된다.
- 포화 용액보다 용질이 적게 녹아 있는 용액을 불포화 용액이라고 하고, 용해 평형을 이루고 있는 용액을 포화 용액이라고 한다.
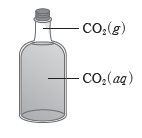
③ 기체가 액체에 녹아 동적 평형 상태에 도달하는 용해 평형도 있다.
예) 밀폐된 용기에 들어 있는 탄산음료 : 이산화 탄소가 음료에 녹는 속도와 음료에서 빠져나오는 속도가 같아 음료 속 이산화 탄소 농도가 일정하게 유지되는 동적 평형 상태이다.
물의 자동 이온화
(1) 물의 자동 이온화
① 물은 대부분 분자로 존재하지만 매우 적은 양의 물이 이온화하여 동적 평형 상태를 이룬다.
② 물의 자동 이온화 반응식
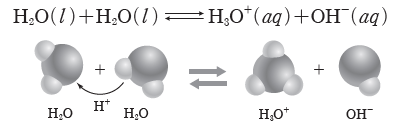
③ 물 분자에서 부분적인 음전하(δ–)를 띤 산소와 이웃한 물 분자에서 부분적인 양전하(δ+)를
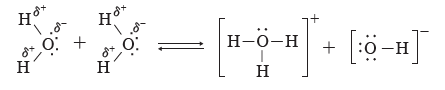
띤 수소가 서로 접근하여 H+의 이동이 생기고 결과적으로 H3O+과 OH–이 생성된다.
(2) 물의 이온화 상수
① 물의 자동 이온화 반응에서 생성된 H3O+과 OH–의 몰 농도 곱을 물의 이온화 상수(Kw)라
고 한다.
H2O(l)+H2O(l) ⇆ H3O+(aq)+OH–(aq) Kw=[H3O+][OH–]
② 물의 자동 이온화 반응은 가역 반응으로서 정반응 속도와 역반응 속도가 같은 동적 평형 상태를 이루므로 일정한 온도에서 [H3O+]와 [OH–]는 일정한 값을 갖고, [H3O+]와 [OH–]의
곱인 물의 이온화 상수(Kw)도 일정한 값을 갖는다.
③ 25℃에서 Kw=1×10-14이고, 순수한 물에서 [H3O+]=[OH–]이므로 [H3O+]=[OH–]
=1×10-7M이다.
④ 일정한 온도에서 물의 이온화 상수(Kw)는 용액의 액성에 관계없이 일정한 값을 갖는다.
예) 25℃에서 Kw=1×10-14이고, [H3O+]=1×10-6M인 수용액의 [OH–]=1×10-9M이다.
수소 이온 농도 지수(pH)
(1) pH
① [H3O+]는 용액의 액성을 설명하기에 유용하지만 그 값이 매우 작아 실제 값을 그대로 사용하기가 불편하다. 이를 개선하기 위해 덴마크 화학자 쇠렌센이 수소 이온 농도 지수(pH)를
제안하였다.
② pH는 [H3O+]의 상용로그 값에 음의 부호를 붙인 것이다.
pH=-log[H3O+]
예) [H3O+]=1×10-5M ⇨ pH=5.0, [H3O+]=1×10-3 M ⇨ pH=3.0
- [H3O+]가 클수록 pH가 작고, [H3O+]가 작을수록 pH가 크다.
- [H3O+]가 102배이면 pH가 2만큼 작다.
③ pH와 마찬가지로 pOH는 [OH–]의 상용로그 값에 음의 부호를 붙인 것이다.
pOH=-log[OH–]
④ 25℃에서 Kw=[H3O+][OH–]=1×10-14이므로 pH+pOH=14.0이다.
예) 25℃에서 pH=6.0인 수용액의 pOH=8.0이다.
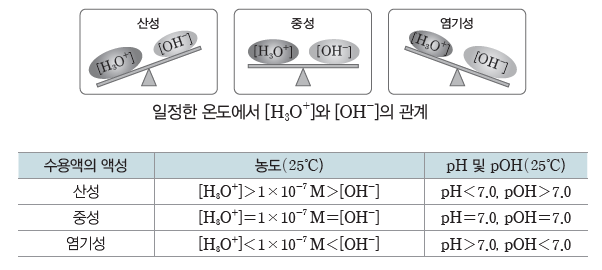
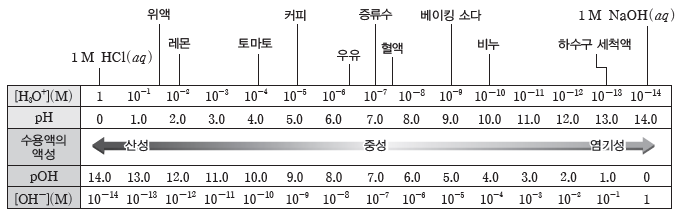
(2) 25℃에서 수용액의 액성과 pH
① 순수한 물이나 모든 수용액은 항상 [H3O+]와 [OH–]의 곱이 1×10-14으로 일정하므로 pH와 pOH의 합은 14.0이다.
② 순수한 물이나 중성 수용액은 물의 자동 이온화에 의해 [H3O+]와 [OH–]가 1×10-7 M로 같으므로 pH와 pOH는 모두 7.0으로 같다.
③ 산성 수용액은 중성 수용액에 비해 [H3O+]가 큰 수용액이다. 따라서 [H3O+]>1×10-7 M
이고, [OH–]<1×10-7 M이므로 pH<7.0이고, pOH>7.0이다.
④ 염기성 수용액은 중성 수용액에 비해 [OH–]가 큰 수용액이다. 따라서 [OH–]>1×10-7 M이고, [H3O+]<1×10-7 M이므로 pOH<7.0이고, pH>7.0이다.
(3) 우리 주변 생활 속 물질의 pH
① pH 측정 방법:우리 주변 생활 속 물질의 pH를 간단히 확인하기 위해 pH 시험지나 pH 미터를 이용한다.
② 25℃에서 1 M HCl(aq)과 NaOH(aq)의 pH : 1 M HCl(aq)은 [H3O+]=1 M이므로 pH는 0(=-log 1)이고, 1 M NaOH(aq)은 [OH–]=1 M이므로 pOH는 0(=-log 1)이고, pH는 14.0이다.
③ 우리 몸속의 위액, 우리가 즐겨 먹는 레몬, 토마토, 커피, 우유는 pH가 7.0보다 작아 산성이고, 우리 몸속의 혈액, 생활용품으로 많이 사용하는 베이킹 소다, 비누, 하수구 세척액은 pH가 7.0보다 커서 염기성이다.
참고자료: EBS 수능특강 화학1