분자 간 상호 작용
⑴ 분자 간 힘과 물질의 상태
① 온도와 분자 운동:액체의 온도가 높아지면 분자의 평균 운동 속력이 증가하면서 분자 운동이 활발해진다. 이때 분자의 운동 에너지가 분자 사이에 작용하는 힘을 극복할 만큼 커지면 물질의 상태가 변하면서 기체 상태로 존재한다.
② 분자 운동과 물질의 상태:물질의 상태에 따른 분자의 평균 운동 에너지는 고체<액체<기체이므로 분자 운동은 기체가 가장 활발하다. 이때 분자 사이에 작용하는 힘의 세기는 고체>액체>기체이다.
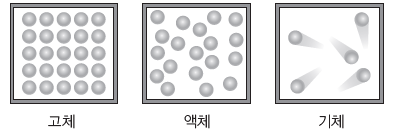
③ 분자 간 힘과 끓는점:분자 사이에 작용하는 힘이 클수록 액체에서 기체로의 상태 변화에 많은 에너지가 필요하므로 끓는점이 높다.
⑵ 쌍극자·쌍극자 힘
① 쌍극자:염화 수소(HCl)와 같은 극성 분자에서 공유 전자쌍은 전기 음성도가 큰 원자 쪽으로 치우쳐 존재하게 된다. 이때 전기 음성도가 큰 Cl는 부분적인 음전하(δ–)를, 전기 음성도가 작은 H는 부분적인 양전하(δ+)를 띠게 되는데, 이와 같이 분자 내에 존재하는 양전하와 음전하의 쌍을 쌍극자라고 한다.
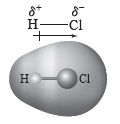
② 쌍극자를 갖는 극성 분자들이 서로 접근하면 쌍극자와 쌍극자 사이의 전기적인 인력이 작용하는데, 이러한 분자 간의 힘을 쌍극자·쌍극자 힘이라고 한다.
③ 쌍극자·쌍극자 힘은 분자의 극성이 클수록 강하다(쌍극자 모멘트의 크기는 분리된 전하의 크기가 클수록, 두 전하 사이의 거리가 멀수록 커진다. 쌍극자 모멘트의 크기가 클수록 대체로 분자의 극성이 크다).
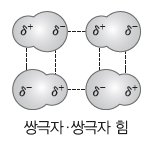
예) 전기적 인력은 전하를 띤 입자의 거리가 가까울수록, 전하의 크기가 클수록 크다.
④ 분자량이 비슷하면 무극성 분자 사이에 작용하는 힘보다 극성 분자 사이에 작용하는 힘이크다.
⑶ 분산력
① 편극 현상:분자에서 전자구름이 일시적으로 한쪽으로 치우쳐서 부분적인 전하를 띠는 현상이 일어나는데, 이를 편극 현상이라고 한다.
② 분산력:무극성 분자 내의 편극 현상에 의해 순간적으로 형성된 쌍극자와 이웃한 분자의 유발 쌍극자 사이에 작용하는 분자 간 힘을 분산력이라고 한다.
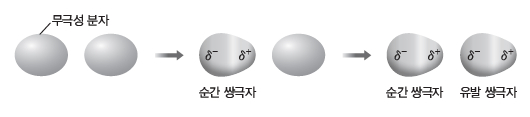
③ 전자의 분포는 분자 간의 영향으로 항상 변화하므로 분산력은 모든 분자 사이에 작용한다.
④ 분자량이 클수록 분자 내 전자가 많아 전자구름의 편극 현상이 크게 일어나므로 대체로 분자량이 큰 분자일수록 분산력이 크다.
예) 메테인과 노말뷰테인:분자량은 노말뷰테인이 메테인보다 크므로 노말뷰테인이 메테인보다 분산력이 크고, 끓는점이 높다.
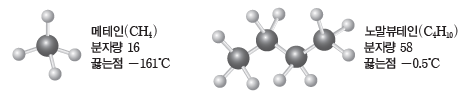
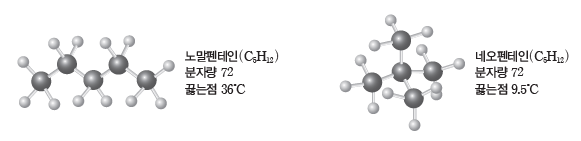
⑤ 분자량이 비슷한 분자의 경우 구조에 따라 분자의 표면적이 클수록 분산력이 크다.
예) 노말펜테인과 네오펜테인 : 노말펜테인과 네오펜테인은 분자량이 같지만 표면적은 노말펜테인이 네오펜테인보다 커서 노말펜테인이 네오펜테인보다 분산력이 크고, 끓는점이 높다.
⑷ 수소 결합
① F, O, N와 같이 전기 음성도가 매우 큰 원자에 결합된 H 원자와 이웃한 분자의 F, O, N원자 사이에 작용하는 강한 인력이다.
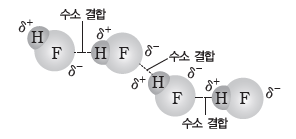
② 수소 결합을 하는 대표적인 물질에는 HF, H2O, NH3 등이 있다.
③ 수소 결합을 하는 물질은 분자량이 비슷한 다른 물질보다 끓는점이 높다.
④ 수소 결합은 분자 사이에 작용하는 강한 힘이다. 그러나 이온 결합, 공유 결합, 금속 결합과 같은 화학 결합에 비해서는 약한 힘이다.
⑤ DNA가 이중 나선 구조를 형성하거나 단백질의 일부가 나선 구조를 이루는 것은 수소 결합이 존재하기 때문으로, 수소 결합은 생명체 내에서도 중요한 역할을 한다.
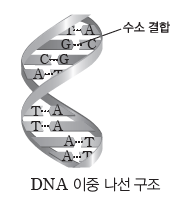
액체의 성질
⑴ 액체
① 외부 압력에 따른 액체의 부피 변화는 기체에 비해 매우 작다.
② 액체는 유동성을 갖는 상태로 일정한 모양이 없고 용기에 따라 모양이 달라진다.
③ 같은 질량의 기체에 비해 그 부피가 매우 작아 기체보다 밀도가 크다.
⑵ 물 분자 구조와 극성
① 분자 구조:물은 산소 원자 1개와 수소 원자 2개가 공유 결합하여 형성된다. 중심 원자인 산소 원자에 2개의 공유 전자쌍과 2개의 비공유 전자쌍이 있어 그림과 같이 분자 모양은 굽은형이다.
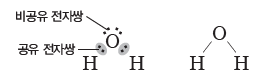
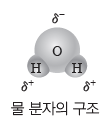
② 극성:물 분자는 전기적으로 볼 때 전체적으로 중성이다. 그러나 전기 음성도가 상대적으로 큰 산소 원자 쪽으로 공유 전자쌍이 치우침에 따라 산소 원자 쪽은 부분적인 음전하(δ–)를 띠고, 수소 원자 쪽은 부분적인 양전하(δ+)를띤다. 또한 굽은 형의 분자 구조를 가지는 물 분자의 쌍극자 모멘트는 0이 아니므로 물은 극성 분자이다.
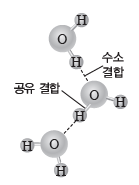
③ 물의 수소 결합:물 분자 내의 부분적인 음전하(δ-)를 띠는 산소 원자는 이웃하는 물 분자의 부분적인 양전하(δ+)를 띠는 수소 원자와 수소 결합을 형성한다. 물 분자 사이에 작용하는 수소 결합은 매우 강하게 작용하는 분자 사이의 힘으로, 이 힘을 끊기 위해서는 많은 에너지가 필요하다. 물은 다른 물질과는 다른 독특한 성질을 나타내는데, 이러한 물의 특성은 대부분 수소 결합과 관련이 있다.
⑶ 수소 결합에 의한 물의 특성
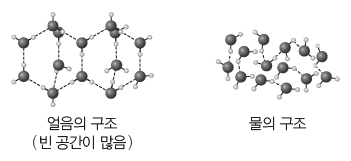
① 밀도와 부피 변화:일반적으로 물질의 상태에 따른 밀도의 크기는 고체>액체>기체이다. 그러나 물은 고체인 얼음의 밀도가 액체인 물의 밀도보다 작다. 즉 같은 질량의 얼음의 부피는 물의 부피보다 크다. 그 이유는 물이 얼 때 1개의 물 분자가 주변에 이웃한 4개의 물 분자와 수소 결합을 하면서 입체 육각 구조의 빈 공간이 있는 결정을 형성하기 때문이다. 이것으로 얼음이 물 위에 뜨는 이유를 설명할 수 있다.
② 녹는점과 끓는점
- 고체가 액체로 상태가 변화되거나 액체가 기체로 상태가 변화될 때는 분자 간 힘을 끊어야하므로 열에너지가 필요하다. 일반적으로 분자 사이에 작용하는 힘이 클수록 고체가 액체로 되거나 액체가 기체로 될 때 더 많은 열에너지가 필요하므로 녹는점과 끓는점이 높다.
- 물은 분자 간에 수소 결합을 형성하므로 분자량이 비슷한 다른 물질에 비해 분자 간 힘이 크다. 따라서 분자량이 비슷한 다른 물질에 비해 녹는점과 끓는점이 높다.
③ 기화열(증발열):물 분자는 분자 간 힘이 커서 분자량이 비슷한 다른 물질에 비해 분자 사이에 작용하는 힘을 끊고 상태를 변화시키는 데 필요한 열량이 크다. 즉, 물은 분자량이 비슷한다른 물질보다 기화열(증발열)이 매우 크다.
예) 더운 여름철 마당에 물을 뿌리면 시원해진다. 그 이유는 증발열이 큰 물이 증발하면서 주위의 열을 많이 흡수하기 때문이다.
④ 비열:물질 1 g의 온도를 1℃ 높이는 데 필요한 열량을 비열이라고 한다.
- 같은 물질이라도 물질의 상태에 따라 비열이 달라지고, 질량이 같을 때 비열이 큰 물질일 수록 온도를 높이는 데 많은 열량이 필요하다. 따라서 비열이 큰 물질일수록 같은 열량에 따른 온도 변화가 작게 나타난다.

- 물은 비열이 크므로 같은 질량의 다른 액체 물질에 비해 가열할 때 온도가 서서히 높아지고 냉각할 때 온도가 서서히 낮아진다.

- 한낮에는 바다보다 비열이 작은 육지의 온도가 더 빨리 높아지기 때문에 육지 쪽 공기가 상대적으로 따뜻하고, 바다 쪽 공기가 상대적으로 차갑다. 반면, 밤에는 육지의 온도가 더 빨리 낮아지기 때문에 육지 쪽 공기가 상대적으로 차갑고, 바다 쪽 공기가 상대적으로 따뜻하다. 이러한 이유로 낮에는 해풍이, 밤에는 육풍이 분다.
- 생물체 내의 물은 외부 기온의 변화에 관계없이 체온을 일정하게 유지하는 데 도움을 준다.
⑤ 표면 장력:표면 장력은 액체의 표면적을 단위 면적만큼 증가시키는 데 필요한 에너지로 정의되며, 표면 장력이 클수록 액체가 표면적을 최소화하려는 경향이 크다.
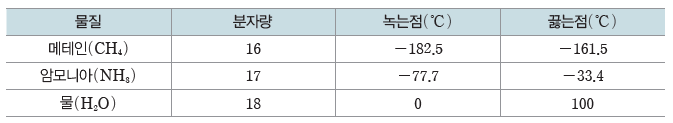
표면 장력이 생기는 이유는 액체 표면의 분자가 내부로만 힘을 받기 때문이다. 분자 사이에 작용하는 힘이 큰 액체일수록 대체로 표면 장력이 크다. 물은 분자 간에 수소 결합을 하기 때문에 다른 물질에 비해 분자 간 힘이 크므로 표면 장력이 크다. 물방울 표면에 있는 물 분자들은 물방울 중심 방향으로만 힘을 받게 되면서 구형을 이루게 되는데, 이는 액체가 구형일 때 가장 작은 표면적을 갖기 때문이다.
예) •물보다 밀도가 큰 바늘이나 클립 등을 물 위에 띄울 수 있다.
- 물이 가득 담긴 유리컵에 클립이나 동전을 넣어도 물이 바로 흘러넘치지 않는다.
- 소금쟁이가 물 위에 떠서 다닐 수 있다.
- 풀잎에 물방울이 둥근 모양으로 맺힌다.
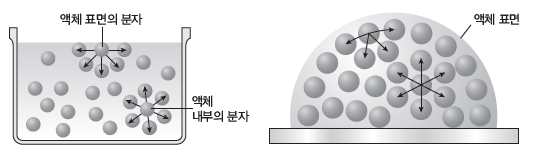
⑥ 모세관 현상:액체 속에 모세관을 넣었을 때 모세관 내의 액체 면이 외부의 액체 면보다 높아지거나 낮아지는 현상을 모세관 현상이라고 한다.
- 물속에 유리 모세관을 넣었을 때는 물과 유리 모세관 사이의 부착력이 물 분자들끼리의 응집력보다 크기 때문에 모세관 안쪽 수면은 모세관 바깥 쪽보다 위로 올라가고, 모양은 아래로 오목해진다.
예) 종이나 수건의 주성분인 셀룰로스에 대하여 물의 부착력이 커서 종이나 수건의 미세한 틈 사이로 물이 스며든다.
- 수은 속에 유리 모세관을 넣었을 때는 수은의 응집력이 수은과 유리 모세관 사이의 부착력보다 크기 때문에 모세관 안쪽 수은 면은 모세관 바깥 쪽보다 아래로 내려가고, 모양은 위로 볼록해진다.
⑷ 액체의 증기 압력 개념 체크
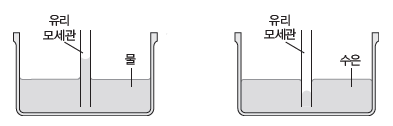
① 증발:액체 표면의 분자는 내부에 있는 분자에 비해 분자 사이에 작용하는 힘이 상대적으로 작기 때문에 기화되어 날아가는데 이러한 현상을 증발이라고 한다.
– 열린 용기에 물을 담아두면 증발이 일어나 시간이 지나면 물의 양이 점점 줄어든다.
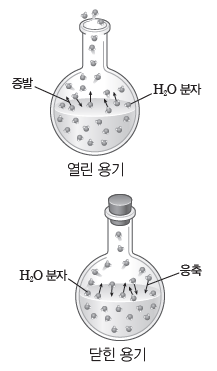
② 응축:액체가 담긴 용기를 뚜껑으로 막으면 오랜 시간이 지나도 액체의 양은 거의 변하지 않는다. 이는 액체 표면에서 증발된 기체 분자들 중 일부가 액체 표면과 충돌을 통해 다시 액체로 변하기 때문인데 이를 응축이라고 한다.
③ 동적 평형과 증기 압력:액체 표면에서 일어나는 증발은 액체 분자의 분자 사이의 힘과 운동에 따라 달라지므로 온도의 영향을 받는다. 따라서 온도가 일정할 때 액체 표면에서 일어나는 증발 속도는 일정하다. 그러나 증발된 기체 분자가 다시 응축되는 것은 단위 부피당 기체분자 수가 많을수록 잘 일어나므로 닫힌 용기에서 응축 속도는 시간이 지날수록 증가하게 된다. 일정한 온도에서 닫힌 용기 내 액체 표면에서의 증발 속도와 증기의 응축 속도가 같아져동적 평형이 되면 증기의 양이 일정하게 유지된다. 이때 증기가 나타내는 압력을 그 액체의 증기 압력이라고 한다.
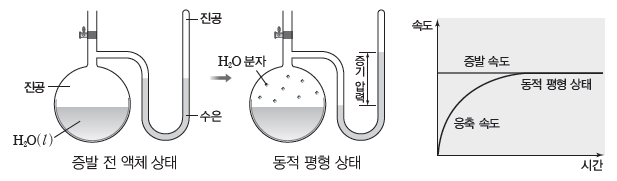
④ 온도와 증기 압력:액체의 온도가 높아지면 분자의 평균 운동 에너지가 증가하면서 액체 표면에 위치한 분자들의 증발 속도가 증가하게 된다. 따라서 증발된 증기 양이 많아지고, 증기의 온도도 높아지며, 이상 기체 방정식(PV=nRT)에서 부피는 일정하고 증기의 양(mol)과 절대 온도(T)가 증가하므로 증기 압력(P)이 커진다. 이와 같이 온도에 따른 액체의 증기 압력을 나타낸 것을 증기 압력 곡선이라고 한다.
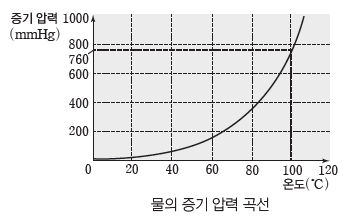
⑤ 증기 압력 곡선과 끓는점:액체의 온도가 높아져서 증기 압력이 점점 증가하다가 액체의 증기압력이 외부 압력과 같아지게 되면 액체 내부에서도 기화가 일어나면서 기포가 발생하게 되는데 이러한 현상을 끓음이라고 한다. 또한 이때의 온도를 액체의 끓는점이라고 한다. 특히 외부 압력이 1 atm일 때의 끓는점을 기준 끓는점이라고 하며 물의 기준 끓는점은 100℃이다.
⑥ 분자 사이의 힘과 끓는점:액체 상태에서 분자 사이의 힘이 클수록 분자 사이의 힘을 끊고 기체로 상태 변화되기 위해 많은 열에너지가 필요하다. 대체로 분자 사이의 힘이 클수록 액체 표면에서의 증발 속도는 작게 나타나며 증기 압력도 작게 나타난다. 분자 사이의 힘이 클수록 외부 압력과 같아지기 위해 보다 많은 열에너지가 필요하므로 높은 온도에서 끓게 된다. 따라서 분자 사이의 힘이 클수록 같은 온도에서 대체로 증기 압력이 작으며, 기준 끓는점이 높은 경향이 있다.
고체
⑴ 고체의 분류
① 결정성 고체:고체를 이루는 원자, 이온, 분자 등이 규칙적으로 배열되어 있다. 기본 입자 사이에 작용하는 힘의 크기가 일정하므로 녹는점이 일정하다. 예) 석영, 염화 나트륨 등
② 비결정성 고체:고체를 이루는 원자, 이온, 분자 등이 불규칙적으로 배열되어 있다. 기본 입자 사이에 작용하는 힘의 크기가 일정하지 않으므로 녹는점이 일정하지 않다. 예) 유리, 엿, 고무 등
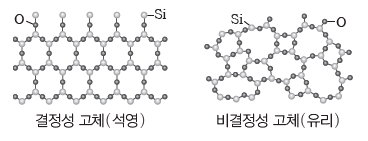
⑵ 결정의 종류
① 분자 결정:대체로 비금속 원자들의 공유 결합으로 형성된 분자들이 분자 사이에 작용하는 힘에 의해 규칙적으로 배열되어 이루어진 결정이다. 일반적으로 화학 결합에 비해 분자 사이에작용하는 힘은 상대적으로 매우 약해 녹는점과 끓는점이 대체로 낮고, 승화성이 있는 물질도 있다. 고체 상태와 액체 상태에서 전기 전도성이 없다.
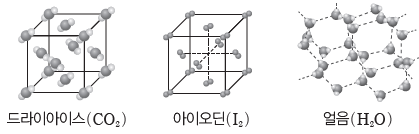
② 공유 결정(원자 결정):구성 원자들이 모두 공유 결합에 의해 그물처럼 복잡하게 배열되어 이루어진 결정이다. 녹는점, 끓는점이 매우 높으며 고체 상태에서 전기 전도성은 대부분 없지만 흑연의 경우에는 구조적인 특성으로 전기 전도성이 있다.
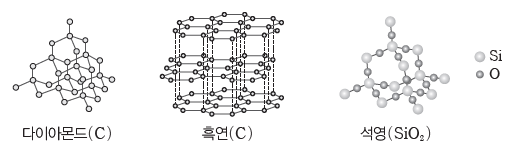
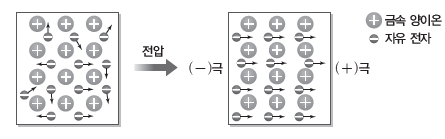
③ 금속 결정:금속은 양전하를 띠는 금속 양이온이 규칙적으로 배열되어 있고, 음전하를 띠는 자유 전자가 금속 양이온 사이를 자유롭게 돌아다니는 상태로 구성되어 있다. 이들 금속 양이온과 자유 전자 사이의 전기적 인력에 의한 화학 결합을 금속 결합이라고 하며, 금속 결합으로 이루어진 결정을 금속 결정이라고 한다. 대부분의 금속은 밀도가 크며, 녹는점과 끓는점이 비교적 높아 수은을 제외한 대부분의 금속은 상온에서 결정성 고체로 존재한다. 또한, 금속 양이온 사이를 자유롭게 돌아다니는 자유 전자 때문에 금속은 다양한 특성을 갖는다.
- 열 전도성과 전기 전도성이 크다.
⇨ 열을 가했을 때 자유 전자의 활발한 운동에 의해 열이 잘 전달되고, 전압을 걸어 주면 금속의 자유 전자가 (-)극에서 (+)극 쪽으로 이동하면서 전류가 잘 흐른다.
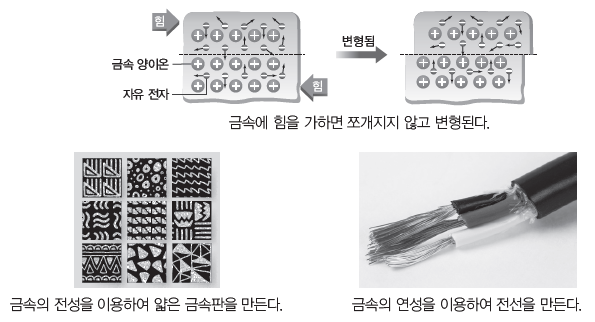
- 전성(펴짐성)과 연성(뽑힘성)이 좋다. ⇨ 외부에서 힘을 가하면 금속 양이온들의 배열이 달라지면서 이웃한 양이온 사이의 반발력이 증가하지만 자유 전자에 의해 반발력이 완화되면서 변형된 형태가 유지된다. 이러한 금속의 성질을 이용하여 가공을 통해 다양한 형태의 금속 제품을 만들거나 실과 같은 가느다란 형태로 뽑아 이용하기도 한다.
④ 이온 결정:양이온과 음이온이 전기적 인력으로 결합되어 이루어진 결정이다. 결정을 이루는 이온의 종류와 크기에 따라 다양하고 독특한 모양의 결정 구조를 갖는다. 대표적인 예는 염화 나트륨과 염화 세슘이다.
- 염화 나트륨 결정의 경우 1개의 나트륨 이온(Na+) 주위에 전후상하좌우로 6개의 염화 이온(Cl–)이 배치되어 있다. 마찬가지로 1개의 염화 이온(Cl–) 주위에 전후상하좌우로 6개의 나트륨 이온(Na+)이 배치되어 있다.
- 염화 세슘 결정의 경우 1개의 세슘 이온(Cs+)이 정육면체의 중심에 있다고 할 때, 8개의
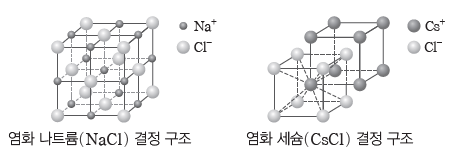
염화 이온(Cl–)이 정육면체의 각 꼭짓점에 배치되어 있다. 마찬가지로 1개의 염화 이온(Cl–) 주위에 8개의 세슘 이온(Cs+)이 정육면체의 각 꼭짓점에 배치되어 있다.
⑤ 결정의 종류와 특성:분자 결정, 공유 결정(원자 결정), 금속 결정, 이온 결정의 4가지 결정은 각각의 몇 가지 물리적 특성을 이용하여 구분할 수 있다.
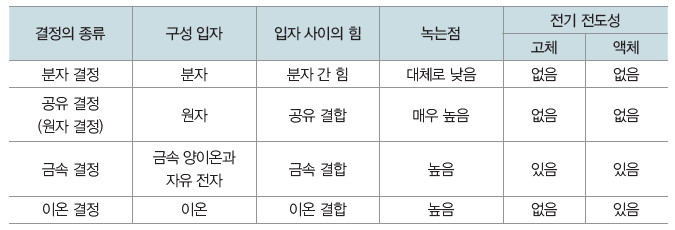
※ 원자 결정 중 흑연과 같은 물질은 전기 전도성이 있음
⑶ 결정 구조
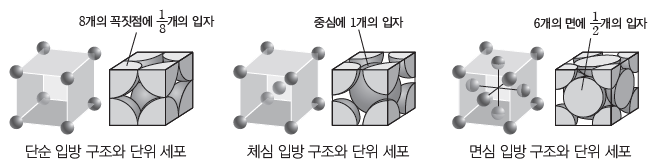
① 단위 세포:각 결정성 고체를 구성하는 입자들은 규칙적인 배열을 갖는 결정 격자 구조를 가지고 있는데, 각 결정 격자 구조에서 3차원적으로 반복되는 가장 작은 단위 구조를 단위 세포라고 한다. 이들 단위 세포가 반복적으로 배열되면서 결정성 고체를 형성한다.
② 단순 입방 구조:단위 세포를 정육면체라고 가정할 때, 정육면체의 8개의 꼭짓점에 동일한입자가 배열된 구조이다.
③ 체심 입방 구조:단위 세포를 정육면체라고 가정할 때, 정육면체의 8개의 꼭짓점과 단위 세포 중심에 각각 동일한 입자가 배열된 구조이다.
④ 면심 입방 구조:단위 세포를 정육면체라고 가정할 때, 정육면체의 8개의 꼭짓점과 단위 세포의 6개의 면 중심에 각각 동일한 입자가 배열된 구조이다.
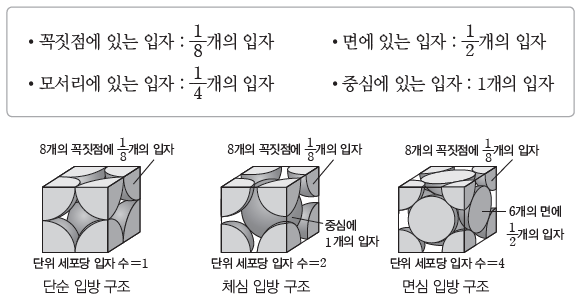
⑤ 단위 세포당 입자 수:단위 세포의 각 꼭짓점은 8개의 단위 세포가 만나는 지점이고, 단위 세포의 각 면은 2개의 단위 세포가 공유한다. 또한 단위 세포의 각 모서리는 4개의 단위 세포가 공유하므로 단위 세포에서 입자가 위치하는 지점에 따라 단위 세포에 포함된 입자 수는 다음과 같다.
⑷ 기체, 액체, 고체 사이의 상변화
① 온도에 따른 상변화:일정한 압력에서 물질을 일정한 열원으로 가열하면 상변화가 없을 때는 온도가 높아지지만, 상변화가 일어날 때는 가해 준 열이 상변화에만 쓰이므로 온도가 일정하게 유지된다. 이때 고체에서 액체로의 상변화 온도는 녹는점이고, 액체에서 기체로의 상변화 온도는 끓는점이다.
예) 1 atm에서 고체인 얼음을 일정한 열원으로 가열하면 0¾에서 물로 상변화가 일어나고, 100℃에서 수증기로 상변화가 일어난다.
② 압력에 따른 상변화:일정한 온도에서 물질에 가해지는 압력을 변화시키면 상변화가 일어난다. 기체에 압력을 가하면 부피가 줄어들면서 기체 분자 사이의 거리가 가까워져 상호 간 작용하는 힘이 증가하므로 액체나 고체로 변하게 된다.
예) 스케이트를 신고 얼음판 위에 서면 얼음이 녹아 물이 되면서 스케이트가 잘 미끄러진다.
참고자료: EBS 수능 특강 화학2