공유 결합
(1) 공유 결합
비금속 원소의 원자들이 전자쌍을 서로 공유하면서 형성되는 결합이다.
(2) 공유 결합의 형성
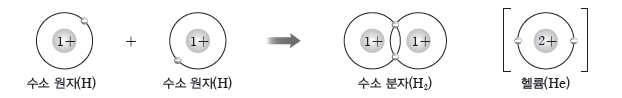
① 수소 분자의 형성:수소 원자 2개가 각각 전자를 1개씩 내놓고 이 전자쌍을 두 수소 원자가 서로 공유함으로써 형성된다. 이때 각각의 수소 원자는 헬륨과 같은 전자 배치를 갖는다.
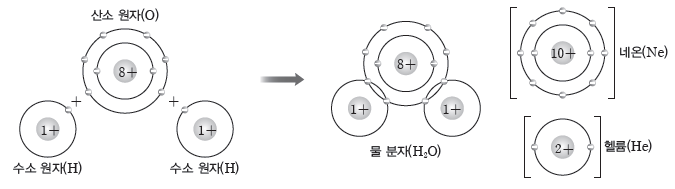
② 물 분자의 형성:산소 원자 1개가 수소 원자 2개와 각각 전자쌍을 1개씩 공유하여 형성되며, 산소 원자는 네온과 같은 전자 배치를, 수소 원자는 헬륨과 같은 전자 배치를 갖는다.
(3) 공유 결합의 형성과 에너지 변화
두 원자 사이의 인력과 반발력이 균형을 이루어 에너지가 가장 낮은 거리에서 공유 결합이 형성된다.
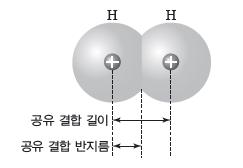
① 공유 결합 길이:공유 결합을 하는 두 원자의 핵 사이의 거리이다.
② 공유 결합 반지름:동일한 원자가 공유 결합할 때 공유 결합 길이의 1/2이다.
(4) 단일 결합과 다중 결합
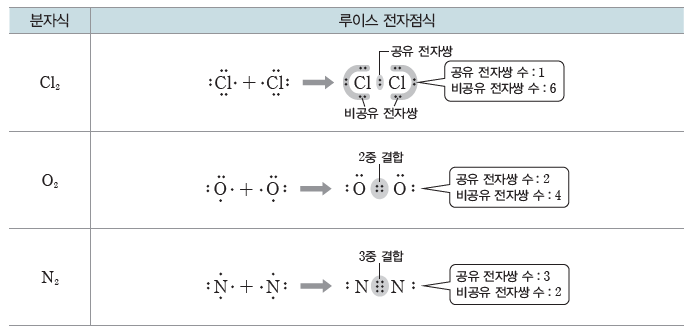
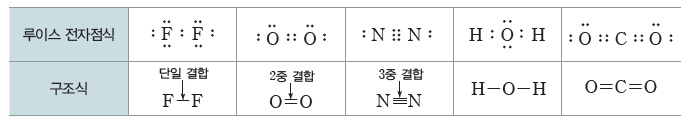
두 원자가 1개의 전자쌍을 공유하고 있으면 단일 결합, 2개의 전자쌍을 공유하고 있으면 2중결합, 3개의 전자쌍을 공유하고 있으면 3중 결합이라고 한다. 2중 결합과 3중 결합을 다중 결합이라고 한다.
① 단일 결합:두 원자가 1개의 전자쌍을 공유하는 결합이다.
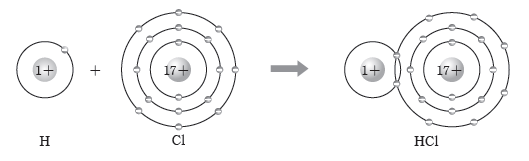
예) 수소(H) 원자와 염소(Cl) 원자는 각각 1개의 전자를 내놓아 1개의 전자쌍을 공유하여 염화 수소(HCl) 분자를 형성한다. 전자쌍 1개를 공유하여 형성되는 결합을 단일 결합이라고 한다.
② 2중 결합:두 원자가 2개의 전자쌍을 공유하는 결합이다.
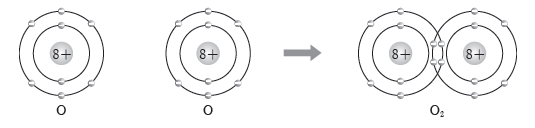
예) 산소(O) 원자 2개는 각각 2개의 전자를 내놓아 2개의 전자쌍을 공유하여 산소(O2) 분자를 형성한다.
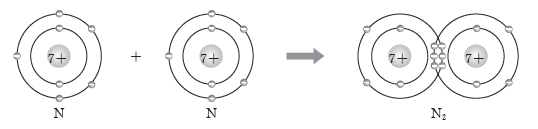
③ 3중 결합:두 원자가 3개의 전자쌍을 공유하는 결합이다.
예) 질소(N) 원자 2개는 각각 3개의 전자를 내놓아 3개의 전자쌍을 공유하여 질소(N2) 분자를 형성한다.
(5) 공유 결합 물질의 성질
① 공유 결합 물질:원자들이 공유 결합하여 형성된 물질로 대부분 분자로 이루어져 있다.
예) 암모니아(NH3), 이산화 탄소(CO2), 메테인(CH4), 포도당(C6H12O6), 설탕(C12H22O11)
② 녹는점과 끓는점:분자로 이루어진 공유 결합 물질은 대부분 녹는점과 끓는점이 낮다.
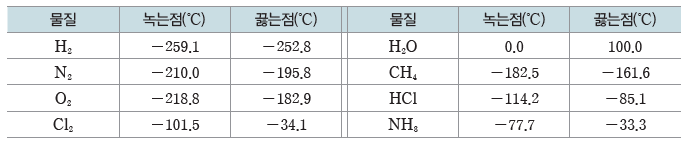
③ 전기 전도성:공유 결합 물질은 고체 상태와 액체 상태에서 대부분 전기 전도성이 없다. 단, 흑연(C)은 전기 전도성을 갖는다.
결합의 극성
(1) 공유 결합과 전기 음성도
① 전기 음성도:공유 결합한 원자가 공유 전자쌍을 끌어당기는 능력을 상대적인 수치로 나타낸 값이다.
- 폴링이 정한 전기 음성도 척도가 가장 널리 사용되는데 플루오린(F)이 4.0으로 가장 크고, 다른 원소는 이보다 작은 값을 갖는다.
- 18족 원소는 매우 안정하여 다른 원자들과 거의 결합을 하지 않으므로 전기 음성도는 18족 원소를 제외하고 다룬다.
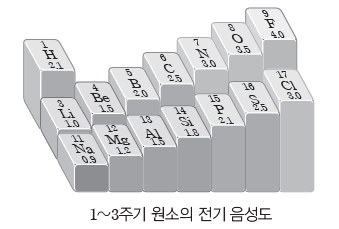
② 전기 음성도의 주기적 변화
- 같은 족에서는 원자 번호가 증가할수록 전기 음성도는 대체로 감소하는 경향이 있다. 같은족에서는 원자 번호가 증가할수록 전자 껍질 수가 많아져 원자핵과 전자 사이의 인력이 감소하므로 공유 전자쌍을 끌어당기는 힘이 약해진다.
- 같은 주기에서는 원자 번호가 증가할수록 전기 음성도는 대체로 증가하는 경향이 있다. 같은 주기에서는 원자 번호가 증가할수록 유효 핵전하가 증가하여 원자핵과 전자 사이의 인력이 강하게 작용하므로 공유 전자쌍을 끌어당기는 힘이 세진다.
③ 전기 음성도가 큰 원자일수록 공유 결합에서 공유 전자쌍을 더 세게 끌어당긴다.
④ 공유 결합을 이룬 두 원자의 전기 음성도 차이가 클수록 전기 음성도가 큰 원자 쪽으로 공유전자쌍이 더 많이 치우친다.
(2) 결합의 극성
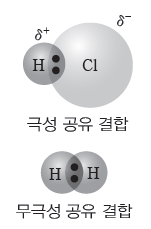
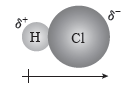
① 극성 공유 결합:전기 음성도가 다른 두 원자 사이의 공유 결합이며, 전기 음성도가 큰 원자가 공유 전자쌍을 강하게 당겨서 부분적인 음전하(δ–)를 띠고, 전기 음성도가 작은 원자는 부분적인 양전하(δ+)를 띤다.
δ+ δ– δ+ δ–
예) H-Cl, H-F
② 무극성 공유 결합:같은 원소의 원자 사이의 공유 결합이며, 결합한 두 원자의 전기 음성도가 서로 같으므로 부분적인 전하가 생기지 않는다.
예) H-H, Cl-Cl, O=O, N≡N
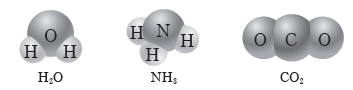
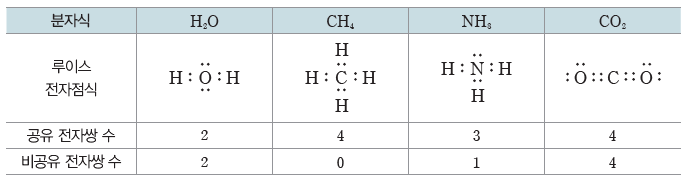
③ 물(H2O), 암모니아(NH3), 이산화 탄소(CO2)는 서로 다른 두 원소가 결합한 분자이므로 모두 극성 공유 결합으로 이루어져 있다.
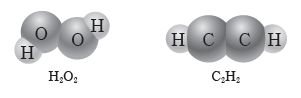
④ 과산화 수소(H2O2), 에타인(C2H2) 등의 분자는 극성 공유 결합과 무극성 공유 결합이 있다.
(3) 쌍극자와 쌍극자 모멘트
① 쌍극자:극성 공유 결합에서 전기 음성도가 큰 원자는 부분적인 음전하(δ–)를 띠고, 전기 음성도가 작은 원자는 부분적인 양전하(δ+)를 띠는데, 크기가 같고 부호가 반대인 전하가 일정한 거리를 두고 분리된 것을 쌍극자라고 한다.
② 쌍극자 모멘트(μ):전하량(q)과 두 전하 사이의 거리(r)를 곱한 값을 쌍극자 모멘트(μ)라고 한다.
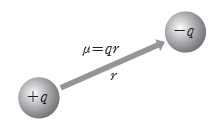
- 쌍극자 모멘트(μ)의 표시:전기 음성도가 작은 원자에서 전기 음성도가 큰 원자를 향하도록 십자 화살표(┼→)를 이용하여 표시한다.
예) 염화 수소(HCl) 분자의 쌍극자 모멘트
결합의 표현
(1) 루이스 전자점식:원소 기호 주위에 원자가 전자를 점으로 표시한 식이다.
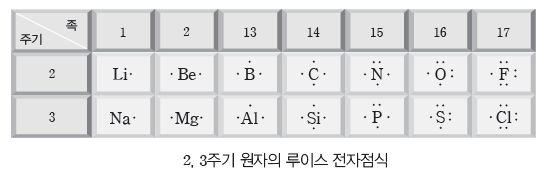
(2) 원자의 루이스 전자점식
① 원자의 원자가 전자 수를 구한다.
② 원소 기호의 주위에 원자가 전자를 점으로 표시한다.
③ 원자가 전자 1개당 점 1개씩 원소 기호의 네 방향(위, 아래, 좌, 우)에 돌아가면서 표시하고, 5개째 전자부터 쌍을 이루도록 표시한다.
(3) 분자의 루이스 전자점식
① 공유 전자쌍과 비공유 전자쌍
- 공유 전자쌍:공유 결합하는 두 원자가 공유하고 있는 전자쌍이다.
- 비공유 전자쌍:원자가 전자 중 공유 결합하는 두 원자가 공유하지 않는 전자쌍이다.
② 원소인 분자의 루이스 전자점식
③ 화합물인 분자의 루이스 전자점식
(4) 이온과 이온 결합 물질의 루이스 전자점식
① 금속 원자는 원자가 전자를 모두 잃어 비활성 기체와 같은 전자 배치를 갖는 양이온이 되고, 비금속 원자는 가장 바깥 전자 껍질에 전자를 얻어 안정한 음이온이 되면서 비활성 기체와 같은 전자 배치를 갖게 된다.
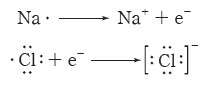
② 양이온과 음이온이 결합하여 이온 결합 물질이 형성된다.
예) 염화 나트륨(NaCl)의 루이스 전자점식

(5) 구조식:공유 결합하는 분자의 전자 배치를 간단하고 편리하게 나타내기 위하여 공유 전자쌍을 결합선(-)으로 나타낸 식이다. 구조식에서 비공유 전자쌍은 생략하기도 한다.
예) 아세트산(CH3COOH)과 에탄올(C2H5OH)의 구조식
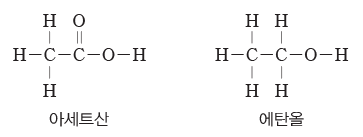
금속 결합의 형성
(1) 금속 결합:금속 양이온과 자유 전자 사이의 정전기적 인력에 의해 형성된다.
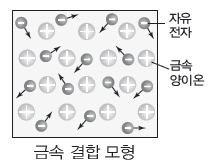
① 자유 전자:금속 원자가 내놓은 원자가 전자로, 금속 양이온 사이를 자유롭게 움직이면서 금속 양이온을 결합시키는 역할을 하는 전자이다.
② 금속 결정:금속 결합을 하여 금속 원자가 규칙적으로 배열된 고체이다.
(2) 금속의 특성:금속 결합을 이루는 금속의 특성이 나타나는 것은 자유 전자 때문이다.
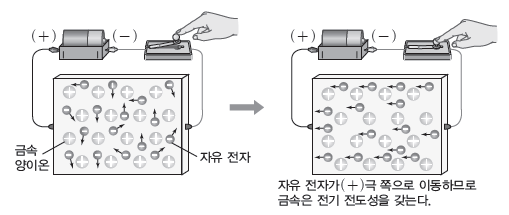
① 전기 전도성:금속은 자유 전자가 자유롭게 움직일 수 있으므로 고체와 액체 상태에서 전기 전도성이 있다. 금속에 전압을 걸어 주면 자유 전자는 (-)극에서 (+)극 쪽으로 이동한다.
② 열전도성:금속을 가열하면 자유 전자가 에너지를 얻게 되고, 에너지를 얻은 자유 전자가 인접한 자유 전자와 금속 양이온에 열에너지를 전달하므로 금속은 열전도성이 매우 크다.
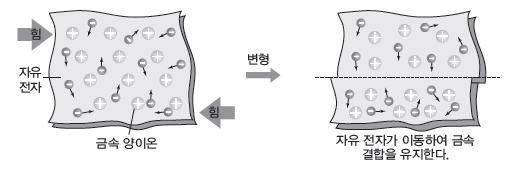
③ 뽑힘성(연성)과 펴짐성(전성):외부의 힘에 의해 금속이 변형되어도 자유 전자가 이동하여 금속 결합을 유지할 수 있으므로 금속은 뽑힘성(연성)과 펴짐성(전성)이 크다.
④ 녹는점과 끓는점:금속은 자유 전자와 금속 양이온 사이의 강한 정전기적 인력에 의해 녹는점과 끓는점이 높다. 따라서 대부분의 금속은 상온에서 고체 상태로 존재하고 단단하다.
화학 결합의 상대적 세기
화학 결합의 세기가 강할수록 그 결합을 끊는 데 상대적으로 많은 에너지가 필요하므로 더 높은 온도에서 상태 변화가 일어난다. 따라서 일반적으로 녹는점이 높은 물질일수록 그 물질을 이루고 있는 화학 결합의 세기가 강하다.
(1) 이온 결합 물질
이온 결합 물질은 양이온과 음이온 사이의 강한 정전기적 인력에 의해 결합되어 있으므로 녹는점과 끓는점이 높다.
예) NaCl의 녹는점:801℃, NaCl의 끓는점:1465℃
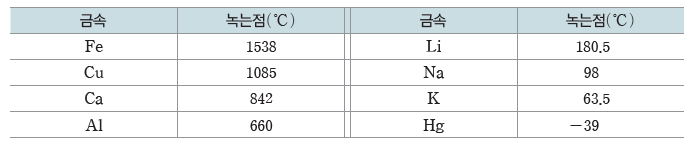
(2) 금속 결합 물질
금속 결합 물질은 자유 전자와 금속 양이온 사이의 강한 정전기적 인력에 의해 녹는점과 끓는점이 높다.
예) Cu의 녹는점:1085℃, Fe의 녹는점:1535℃
(3) 공유 결합 물질
공유 결합 물질은 분자 사이의 인력이 약한 편이므로 대체로 이온 결합 물질보다 녹는점과 끓는점이 낮다. 그러나 흑연, 다이아몬드와 같이 공유 결정을 이루는 물질의 경우 녹는점과 끓는점이 매우 높다.
예) H2의 녹는점:-259℃, 흑연의 녹는점:4000℃ 이상
