화학 전지
⑴ 산화 환원 반응
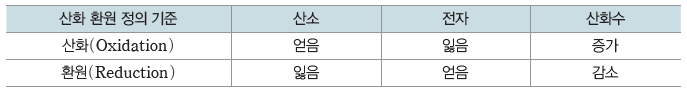
① 산화와 환원:산화는 산소를 얻거나 전자를 잃거나 산화수가 증가하는 반응이고, 환원은 산소를 잃거나 전자를 얻거나 산화수가 감소하는 반응이다.
② 산화제와 환원제:산화제는 자신은 환원되면서 다른 물질을 산화시키는 물질이고, 환원제는 자신은 산화되면서 다른 물질을 환원시키는 물질이다.
③ 산화와 환원의 동시성:한 물질이 전자를 잃어 산화될 때 다른 물질이 그 전자를 얻어 환원되므로 산화 반응과 환원 반응은 항상 동시에 일어난다.

⑵ 금속의 반응성
① 금속들은 공기 중의 산소, 물, 산 수용액과 반응하는 정도가 서로 다르다. ⇨ 금속이 공기 중의 산소, 물, 산 수용액과 반응하는 빠르기나 반응 여부에 따라 금속의 반응성 순서가 정해진다.
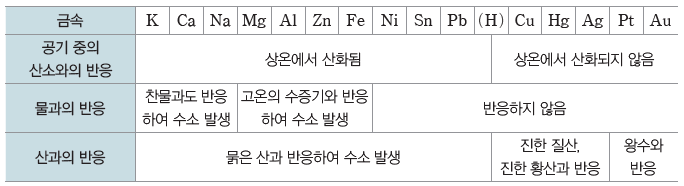
② 금속과 산의 반응:산 수용액에 수소(H2)보다 반응성이 큰 금속(Zn, Fe, Ni 등)을 넣으면금속은 산화되어 양이온이 되고, H+이 환원되어 수소(H2) 기체가 발생한다. 수소(H2)보다 반응성이 작은 금속(Au, Pt, Ag, Hg, Cu)은 H+과 반응하지 않는다.
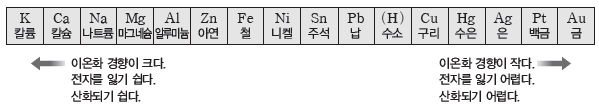
③ 이온화 경향:금속 원소는 일반적으로 전자를 잃고 양이온이 되려는 성질이 있는데 이를 이온화 경향이라고 한다. 금속의 이온화 경향이 클수록 전자를 잃고 산화되기 쉽다.
⑶ 화학 전지의 원리
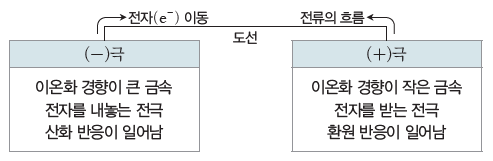
① 화학 전지:금속의 반응성 차이에 의한 자발적인 산화 환원 반응을 이용하여 화학 에너지를 전기 에너지로 전환시키는 장치로 (-)극과 (+)극의 두 전극과 전해질 용액으로 구성된다.
⇨ 일반적으로 (-)극과 (+)극의 두 전극은 이온화 경향 차이가 큰 금속을 이용한다. (-)극은 이온화 경향이 큰 금속으로 (-)극에서는 산화 반응이 일어나고, (+)극은 이온화 경향이 작은 금속으로 (+)극에서는 환원 반응이 일어난다.
- 전자는 도선을 따라 (-)극에서 (+)극으로 이동하고, 전류는 (+)극에서 (-)극으로 흐른다.
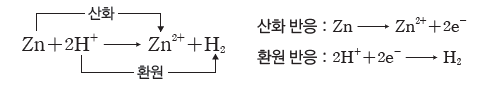
② 볼타 전지:아연(Zn)판과 구리(Cu)판을 묽은 황산(H2SO4(aq))에 담그고 도선으로 두 금속판을 연결한 전지이다.
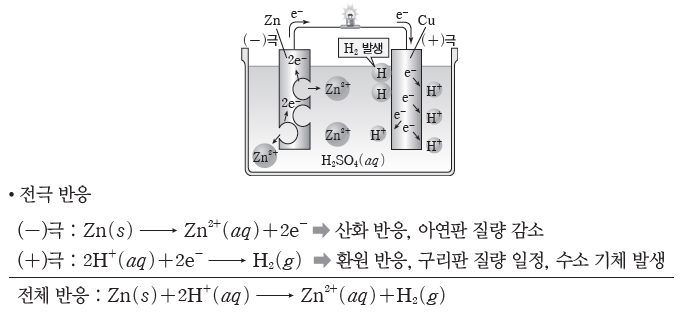
⇨ 아연판에서는 아연(Zn)이 전자를 잃고 아연 이온(Zn2+)으로 산화되어 용액 속으로 녹아들어 가고, 전자는 도선을 따라 구리판 쪽으로 이동한다. 구리판에서는 수소 이온(H+)이 전자를 얻어 수소(H2) 기체로 환원된다. 이때 산화 반응이 일어나는 아연판은 (-)극이 되고, 환원 반응이 일어나는 구리판은 (+)극이 된다.
- 볼타 전지에서는 분극 현상으로 전류가 잠시 흐르다가 전압이 급격히 떨어진다.
③ 다니엘 전지:아연(Zn)판을 황산 아연(ZnSO4)수용액에 담그고, 구리(Cu)판을 황산 구리(CuSO4) 수용액에 담근 다음 두 전해질 수용액을 염다리로 연결하고, 도선으로 두 금속판을 연결한 전지이다.
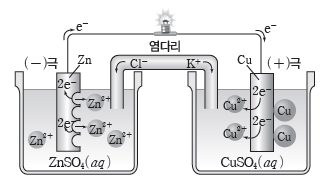

⇨ 아연판에서는 아연(Zn)이 전자를 잃고 아연 이온(Zn2+)으로 산화되어 용액 속으로 녹아들어 가고, 전자는 도선을 따라 구리판 쪽으로 이동한다. 구리판에서는 구리 이온(Cu2+)이 전자를 얻어 구리(Cu)로 석출된다. 이때 산화 반응이 일어나는 아연판은 (-)극이 되고, 환원 반응이 일어나는 구리판은 (+)극이 된다.
⇨ 반응이 진행됨에 따라 (-)극인 Zn 전극 주위에는 Zn2+이 계속 생성되므로 양이온이 음이온보다 많아지고, (+)극인 Cu 전극 주위에는 Cu2+이 계속 소모되므로 양이온이 음이온보다 적어져 양전하와 음전하의 불균형이 생긴다. 염다리를 통해 양이온인 K+이 Cu 전극 쪽으로 이동하고, 음이온인 Cl–이 Zn 전극 쪽으로 이동하면서 전하의 불균형이 해소되어 두 전해질 용액은 전기적으로 중성을 유지한다.
⑷ 실용 전지(여러 가지 전지)
볼타 전지와 다니엘 전지와 같은 화학 전지는 사용하기 불편하므로 일상생활에서는 사용하기 편한 실용 전지가 사용된다. 실용 전지에는 충전할 수 없는 1차 전지와 충전하여 다시 사용할 수 있는 2차 전지가 있다.
① 건전지 ( 망가니즈 건전지 )
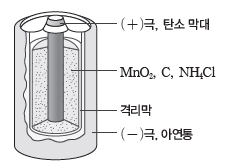
- (-)극은 아연(Zn)통, (+)극은 탄소(C) 막대를 사용하며, 전해질은 염화 암모늄(NH4Cl) 포화 수용액에 이산화 망가니즈(MnO2)와 탄소(C) 가루를 섞은 반죽 형태로 수분이 거의 없다.
- 값이 저렴하고 가벼우며 다양한 크기로 만들 수 있지만 산화 환원 반응으로 물이 생겨 부식
이 일어날 수 있으며, 다른 전지에 비해 전압이 빨리 떨어지는 단점이 있다.
② 알칼리 건전지
- 망가니즈 건전지의 산성 전해질인 염화 암모늄(NH4Cl) 대신 염기성인 수산화 칼륨(KOH)을 전해질로 사용한 전지이다.
- 산성 전해질의 경우보다 아연(Zn)의 부식이 잘 일어나지 않으므로 망가니즈 건전지에 비해 수명이 길고, 전압이 일정하게 유지된다.
③ 납축전지
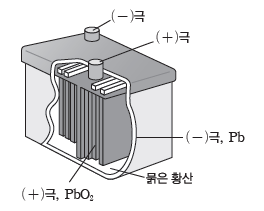
- 묽은 황산(H2SO4(aq))에 납(Pb)판과 이산화 납(PbO2)판을 넣어 만든 화학 전지로 Pb판이 (-)극이고, PbO2판이 (+)극이다.
- 충전이 가능한 2차 전지로 방전될 때 황산 납(PbSO4)이 생성되어 양쪽 전극의 질량이 증가하고, 황산 수용액의 농도는 묽어진다.
④ 리튬 이온 전지

- 리튬(Li)은 원자량이 가장 작은 금속으로 가볍고 에너지 저장 능력이 매우 크다. 따라서 리튬 이온 전지는 소형화되는 스마트폰, 태플릿 PC, 노트북 등 휴대용 전자 기기에 널리 쓰이는 2차 전지이다.
- (-)극으로 흑연(C), (+)극으로 리튬 코발트 산화물(LiCoO2)과 리튬 망가니즈 산화물(LiMn2O4) 등이 사용된다.
- 리튬 이온이 (-)극에서 (+)극으로 이동하면서 전류가 흐른다. 충전 시에는 리튬 이온이 (+)극에서 (-)극으로 이동한다.
전기 분해
⑴ 전기 분해
① 전기 에너지를 이용하여 비자발적인 산화 환원 반응을 일으키는 과정을 전기 분해라고 한다.
② 전해질의 수용액이나 용융액에 직류 전류를 흘려주면 양이온은 (-)극으로 이동하고, 음이온은 (+)극으로 이동한다. 이때 (-)극에서는 전자를 얻기 쉬운 경향이 큰 물질의 환원 반응이 일어나고, (+)극에서는 전자를 잃기 쉬운 경향이 큰 물질의 산화 반응이 일어난다.
③ 산화 반응이 일어나는 전극을 산화 전극, 환원 반응이 일어나는 전극을 환원 전극이라고 한다. 전기 분해에서 (-)극은 환원 전극이고, (+)극은 산화 전극이다.
⑵ 전해질 용융액의 전기 분해
① 염화 나트륨(NaCl) 용융액의 전기 분해
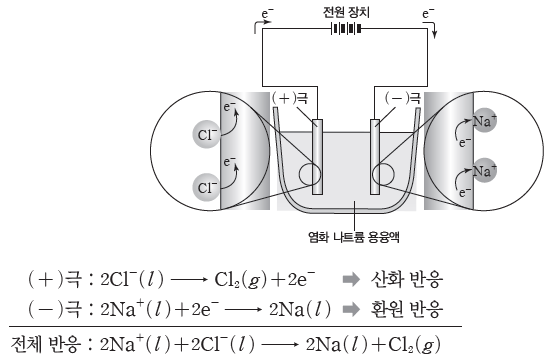
⇨ 염화 나트륨 용융액에 전극을 넣고 직류 전원을 연결하면 (+)극에서는 염화 이온(Cl–)이 전자를 내놓고 산화되어 염소(Cl2) 기체가 발생하고, (-)극에서는 나트륨 이온(Na+)이 전자를 얻고 환원되어 나트륨(Na)이 생성된다.
② 염화 마그네슘(MgCl2) 용융액의 전기 분해
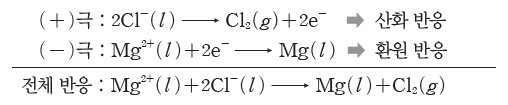
⇨ 염화 마그네슘 용융액에 전극을 넣고 직류 전원을 연결하면 (+)극에서는 염화 이온(Cl–)이 전자를 내놓고 산화되어 염소(Cl2) 기체가 발생하고, (-)극에서는 마그네슘 이온(Mg2+)이 전자를 얻고 환원되어 마그네슘(Mg)이 생성된다.
⑶ 전해질 수용액의 전기 분해
① 전해질 수용액에는 전해질의 양이온, 음이온, H2O이 존재하므로 전기 분해할 때 각 전극에서 양이온, 음이온, H2O 분자가 산화 환원 반응 경쟁을 한다.
- (+)극 : 전해질의 음이온과 H2O 중에서 산화되기 쉬운(전자를 잃기 쉬운) 물질이 먼저 산화된다.
⇨ F–, NO3–, SO42-, CO32-, PO43- 등은 산화되기 어려우므로 H2O이 먼저 산화되면서 산소(O2) 기체가 발생하고 수소 이온(H+)이 생성된다.
2H2O(l) → O2(g)+4H+(aq)+4e-
⇨ Cl–, Br–, OH– 등은 H2O보다 산화되기 쉬우므로 먼저 산화된다.
2Cl–(aq) → Cl2(g)+2e-
4OH–(aq) → O2(g)+2H2O(l)+4e-
- (-)극 : 전해질의 양이온과 H2O 중에서 환원되기 쉬운(전자를 얻기 쉬운) 물질이 먼저 환원된다.
⇨ Li+, Na+, K+, Mg2+, Ca2+, Al3+ 등은 환원되기 어려우므로 H2O이 먼저 환원되면서 수소(H2) 기체가 발생하고 수산화 이온(OH-)이 생성된다.
2H2O(l)+2e- → H2(g)+2OH-(aq)
⇨ Cu2+, Ag+ 등은 H2O보다 환원되기 쉬우므로 먼저 환원되어 금속으로 석출된다. Cu2+(aq)+2e- → Cu(s)
② 염화 구리(CuCl2) 수용액의 전기 분해

③ 염화 나트륨(NaCl) 수용액의 전기 분해

④ 황산 구리(CuSO4) 수용액의 전기 분해

⑷ 전기 분해의 이용
① 전기 도금:전기 분해의 원리를 이용하여 물체에 다른 금속의 막을 입히는 것을 전기 도금이라고 한다.
- 금속의 이온이 들어 있는 용액에 전극을 넣고 전류를 흘려주면 (+)극에서는 금속의 산화 반응이 일어나 금속이 이온화되고, (-)극에서는 금속 이온의 환원 반응이 일어나 금속이 석출된다.
⇨ 도금 재료인 금속은 전원 장치의 (+)극에 연결하고, 도금할 물체는 전원 장치의 (-)극에 연결한다.
② 은 도금 : 숟가락에 은(Ag) 도금을 할 때 (+)극에는 은(Ag)판을, (-)극에는 숟가락을 연결한 후, 은 이온(Ag+)이 들어 있는 수용액에 담가 전류를 흘려주면 숟가락에 은 도금이 된다.
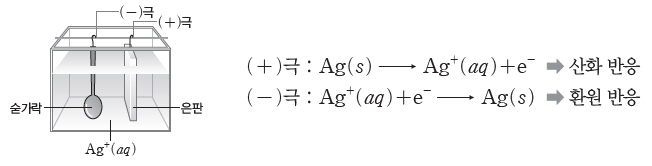
수소 연료 전지
⑴ 연료 전지
① 공급된 연료를 이용하여 자발적인 산화 환원 반응을 일으키게 하여 화학 에너지를 전기 에너지로 전환하는 장치이다.
② 반응물이 소모되면 폐기하거나 재충전해야 하는 화학 전지와는 달리 연료 전지는 반응물이전지 내부에 저장되어 있지 않고 외부로부터 계속해서 공급됨으로써 지속적으로 작동되는 전지이므로 충전할 필요가 없다.
⑵ 수소 연료 전지
① 수소 연료 전지:연료인 수소가 공기 중의 산소와 반응할 때 발생하는 에너지를 전기 에너지로 전환시키는 전지를 수소 연료 전지라고 한다.
② 수소 연료 전지의 구성:수소 연료 전지는 2개의 전극과 분리막, 전해질로 이루어져 있고, 외부에서 수소(H2) 기체와 산소(O2) 기체가 계속 공급된다.
⇨ 수소 연료 전지는 작동 온도와 전해질의 종류에 따라 여러 가지 종류가 있다.
③ 수소 연료 전지의 전기 발생 원리
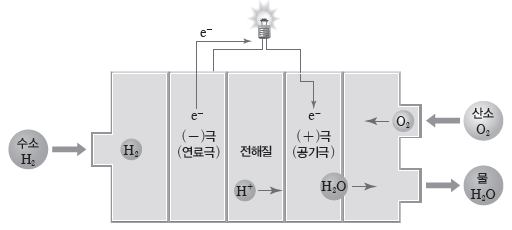
- 공급된 수소(H2) 기체는 (-)극인 연료극에서 수소 이온(H+)과 전자로 분해된다.
⇨ H+은 전해질을 거쳐 (+)극인 공기극으로 이동한다.
⇨ 전자는 외부 회로를 따라 이동하며 전류가 발생한다.
⇨ 공기극에서 H+과 전자, 산소(O2) 기체가 반응하여 물이 생성된다.
④ 수소 연료 전지의 전극 반응식
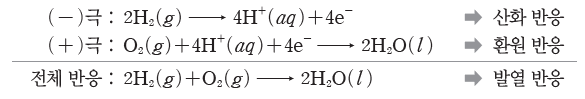
⇨ 수소 연료 전지의 생성물은 물(H2O)이므로 환경 오염을 거의 일으키지 않고, 소음도 없다. 또한 에너지 효율도 40%~60%로 매우 높으며, 반응 과정에서 방출되는 열을 이용하면 에너지 효율은 80% 정도가 된다. 하지만 수소 연료 전지의 실용성을 높이기 위해서는 수소를 효율적으로 생산하는 기술과 수소 저장 기술 등 해결해야 할 과제가 남아 있다.
⑤ 수소 생산 기술:수소를 생산하는 방법으로는 전기 에너지를 이용하여 화석 연료를 리포밍(개질)하는 방법, 미생물을 이용하는 방법, 물을 전기 분해하는 방법, 물의 광분해 반응 등이있다.
참고자료: EBS 수능 특강 화학2