산과 염기의 세기
⑴ 이온화와 산·염기의 세기
① 강산과 약산:물에 녹아 대부분 이온화하는 산을 강산, 물에 녹아 일부만 이온화하는 산을 약산이라고 한다.
예) 강산:염산(HCl), 황산(H2SO4), 질산(HNO3) 등
약산:탄산(H2CO3), 인산(H3PO4), 아세트산(CH3COOH) 등
- 같은 온도와 농도의 수용액에서 강산은 약산보다 이온화하는 정도가 커 수소 이온(H+)을 더 많이 내놓는다.
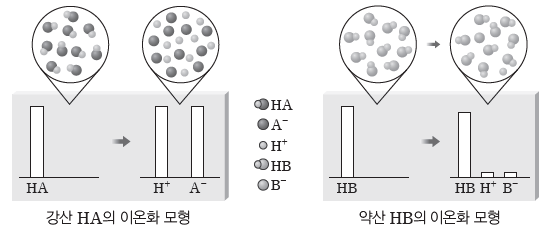
② 강염기와 약염기:물에 녹아 대부분 이온화하는 염기를 강염기, 물에 녹아 일부만 이온화하는 염기를 약염기라고 한다.
예) 강염기:수산화 나트륨(NaOH), 수산화 칼륨(KOH), 수산화 칼슘(Ca(OH)2) 등
약염기 : 암모니아(NH3), 메틸 아민(CH3NH2) 등
- 같은 온도, 농도, 부피인 수용액에서 강염기는 약염기보다 수산화 이온(OH–)을 더 많이 내놓는다.
⑵ 이온화 상수와 산과 염기의 세기
① 산의 이온화 상수(Ka):산 HA는 물에 녹아 다음과 같이 이온화 평형을 이룬다.
HA(aq)+H2O(l) ⇆ A–(aq)+H3O+(aq)
이 반응의 평형 상수 K= [H3O+][A–]/[HA][H2O]이다. 수용액에서 용매인 물의 농도는 평형 상수를 구하는 식에 나타내지 않으며, 상수 Ka로 나타내면 Ka= [H3O=][A–]/[HA]이고, 이때 Ka를 산의 이온화 상수라고 한다.
② 염기의 이온화 상수(Kb):염기 B가 물에 녹아 이온화 평형을 이룰 때 염기의 이온화 상수Kb는 다음과 같다.
B(aq)+H2O(l) ⇆ BH+(aq)+OH–(aq) Kb= [BH+][OH–]/[B]
③ Ka와 Kb의 성질
- Ka와 Kb는 일종의 평형 상수이므로 온도에만 영향을 받고, 온도가 일정하면 농도에 관계 없이 항상 일정하다.
- Ka가 클수록 이온화가 잘 되어 [H3O+]가 크므로 상대적으로 강한 산이고, Ka가 작을수록 상대적으로 약한 산이다.
- Kb가 클수록 이온화가 잘 되어 [OH–]가 크므로 상대적으로 강한 염기이고, Kb가 작을수록 상대적으로 약한 염기이다.
- 몇 가지 산의 이온화 상수(Ka)

⇨ 산의 세기:HCl>CH3COOH>HCN
- 몇 가지 염기의 이온화 상수(Kb)
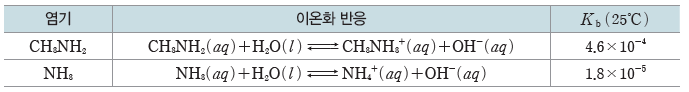
⇨ 염기의 세기:CH3NH2>NH3
⑶ 짝산 짝염기와 산의 세기
① 산과 염기:브뢴스테드·로리 정의에 의하면 산은 수소 이온(H+)을 내놓는 물질, 염기는 수소 이온(H+)을 받는 물질이다.
② 짝산 짝염기:수소 이온(H+)의 이동에 의해 산과 염기로 되는 한 쌍의 산과 염기를 짝산 짝염기라고 한다.
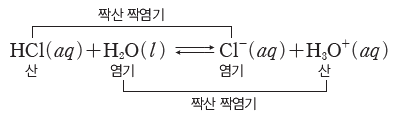
- 산 HCl의 짝염기는 Cl–이고, 염기 H2O의 짝산은 H3O+이다.
③ 이온화 상수와 평형:산이나 염기가 수용액에서 평형을 이룰 때 이온화 상수가 큰 물질은 정반응이 우세한 평형을 이루고, 이온화 상수가 작은 물질은 역반응이 우세한 평형을 이룬다.
④ 짝산과 짝염기의 상대적 세기:짝산과 짝염기의 쌍들이 H+을 주고받는 정도에 따라 산과 염기의 상대적 세기를 나타낼 수 있다. ⇨ 산의 세기가 강할수록 그 짝염기의 세기는 약하고,산의 세기가 약할수록 그 짝염기의 세기는 강하다.
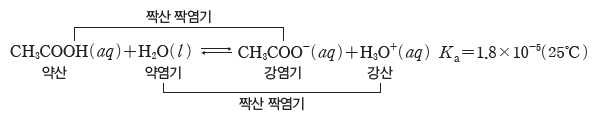
예) 약산인 CH3COOH의 이온화 반응은 Ka가 매우 작으므로 역반응이 우세한 평형을 이룬다. H3O+은 CH3COOH보다 산의 세기가 강하므로 H3O+의 짝염기인 H2O은 CH3COOH의 짝염기인 CH3COO–보다 염기의 세기가 약하다.
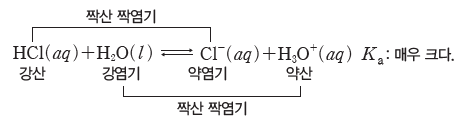
예) 강산인 HCl의 이온화 반응은 Ka가 매우 크므로 정반응이 우세한 평형을 이룬다. HCl은 H3O+보다 산의 세기가 강하므로 HCl의 짝염기인 Cl-은 H3O+의 짝염기인 H2O보다 염기의세기가 약하다.
⑷ 짝산 짝염기의 이온화 상수
① 산 HA의 이온화 평형이 HA(aq)+H2O(l) ⇆ A–(aq)+H3O+(aq)일 때 HA의 짝염기인 A–의 이온화 평형은 A–(aq)+H2O(l) ⇆ HA(aq)+OH–(aq)이다.
② 산 HA의 이온화 상수는 Ka= [H3O+][A–]/[HA]이고, 염기 A–의 이온화 상수는
Kb= [HA][OH–]/[A–]이므로 Ka×Kb= [H3O+][A–]/[HA]×[HA][OH–]/[A–]=[H3O+][OH–]=Kw이다.
염의 가수 분해
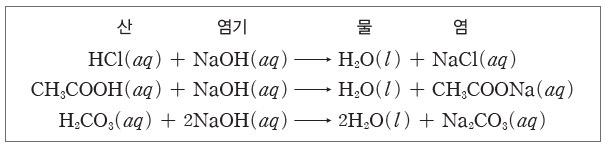
⑴ 염:산의 음이온과 염기의 양이온이 결합하여 생성된 이온 결합 물질을 염이라고 한다. 다음과 같이 산과 염기가 중화 반응하면 물과 염이 생성된다.
⑵ 염의 가수 분해:염의 수용액에서 염을 이루는 이온이 물과 반응하여 H3O+이나 OH–을 생성하는 반응을 염의 가수 분해라고 한다. 가수 분해에 의해 염 수용액의 액성이 달라진다.
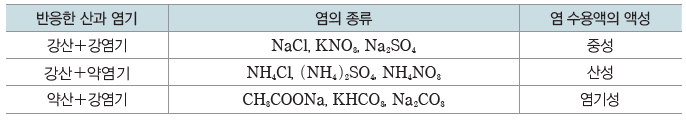
① 강산과 강염기가 반응하여 생성된 염:강산의 음이온과 강염기의 양이온이 모두 가수 분해하지 않는다.
예) NaCl, KCl, NaNO3 등:양이온과 음이온이 가수 분해하지 않으므로 수용액은 중성이다.
이온화 : NaCl(aq) → Na+(aq)+Cl–(aq)
② 약산과 강염기가 반응하여 생성된 염:약산의 짝염기인 음이온이 가수 분해하여 OH–을 생성하므로 수용액은 염기성을 나타낸다.
예) CH3COONa, NaHCO3, Na2CO3 등
이온화 : CH3COONa(aq) → CH3COO–(aq)+Na+(aq)
가수 분해 : CH3COO–(aq)+H2O(l) ⇆ CH3COOH(aq)+OH–(aq)
③ 강산과 약염기가 반응하여 생성된 염:약염기의 짝산인 양이온이 물과 반응하여 H3O+을 생성하므로 수용액은 산성을 나타낸다.
예) NH4Cl, (NH4)2SO4 등
이온화 : NH4Cl(aq) → NH4+(aq)+Cl–(aq)
가수 분해 : NH4+(aq)+H2O(l) ⇆ NH3(aq)+H3O+(aq)
완충 용액
⑴ 완충 용액:약산과 그 약산의 짝염기가 섞여 있는 수용액이나 약염기와 그 약염기의 짝산이 섞여 있는 수용액은 산이나 염기를 소량 가해도 pH가 거의 변하지 않는다. 이러한 용액을
완충 용액이라고 한다.
- 증류수는 산이나 염기를 조금 넣어도 pH가 크게 변하지만, 완충 용액은 pH가 거의 변하지 않는다.
- 몇 가지 완충 용액과 pH
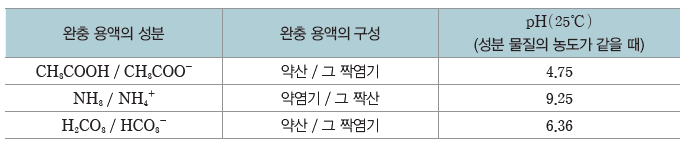
① CH3COOH과 CH3COONa으로 이루어진 완충 용액
- 이온화 평형
CH3COOH(aq)+H2O(l) ⇆ CH3COO–(aq)+H3O+(aq)
CH3COONa(aq) → CH3COO–(aq)+Na+(aq)
- 용액에 약산인 CH3COOH과 그 짝염기인 CH3COO–이 존재한다.
⇨ 소량의 산을 가하거나 염기를 가해도 pH가 거의 변하지 않는다.
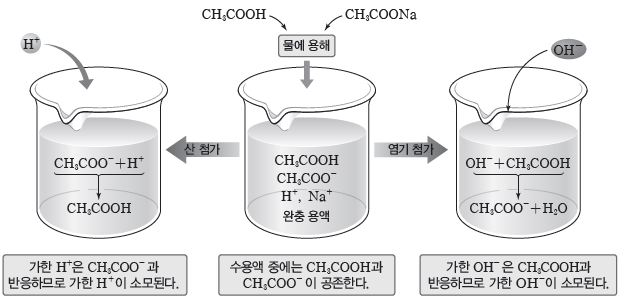
⇨ HCl(aq)을 소량 가할 때:HCl(aq)의 H+이 CH3COO–과 반응하여 CH3COOH이 되므로 가한 H+이 소모되어 수용액의 pH는 거의 변하지 않는다.
⇨ NaOH(aq)을 소량 가할 때:NaOH(aq)의 OH–은 CH3COOH과 반응하여 CH3COO–과 H2O이 되므로 가한 OH–이 소모되어 수용액의 pH는 거의 변하지 않는다.
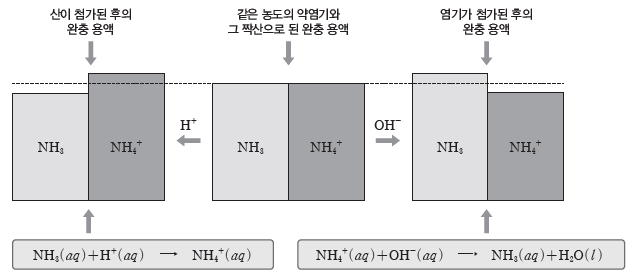
② NH3와 NH4Cl으로 이루어진 완충 용액
- 이온화 평형
NH3(aq)+H2O(l) ⇆ NH4+(aq)+OH–(aq)
NH4Cl(aq) ⇨ NH4+(aq)+Cl–(aq)
- 용액에 약염기인 NH3와 그 짝산인 NH4+이 존재한다.
⇨ 소량의 산을 가하거나 염기를 가해도 pH가 거의 변하지 않는다.
⇨ HCl(aq)을 소량 가할 때:HCl(aq)의 H+이 NH3와 반응하여 NH4+이 되므로 가한 H+이 소모되어 수용액의 pH는 거의 변하지 않는다.
⇨ NaOH(aq)을 소량 가할 때:NaOH(aq)의 OH–은 NH4+과 반응하여 NH3와 H2O이 되므로 가한 OH–이 소모되어 수용액의 pH는 거의 변하지 않는다.
⑵ 생체 내 완충 용액
① 혈액은 pH가 7.4 정도로 일정하게 유지되는 완충 용액이다. 생체 내에서 일어나는 화학 반응은 다양한 효소가 관여하며, 효소의 작용은 pH의 영향을 크게 받으므로 적정한 pH를 유지하는 것이 매우 중요하다.
- 혈액에서의 완충 용액:혈액에서는 탄산(H2CO3)과 탄산수소 이온(HCO3–)의 완충 용액, 인산이수소 이온(H2PO4–)과 인산수소 이온(HPO42-)의 완충 용액 등이 완충 작용을 한다.
② H2CO3과 HCO3–의 완충 용액
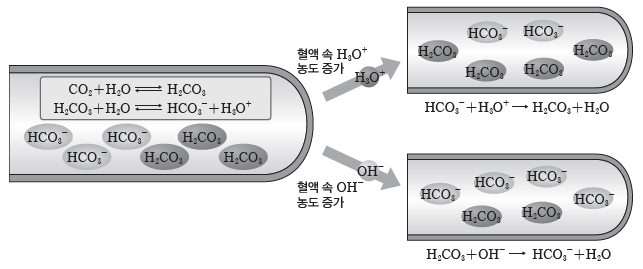
- 혈액에 녹은 이산화 탄소(CO2)와 물(H2O)이 반응하여 H2CO3을 생성하며, 혈액 속에서H2CO3과 그 짝염기인 HCO3-은 평형을 이룬다.
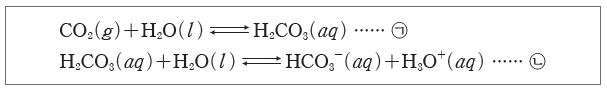
⇨ 혈액 속 H3O+의 농도 증가:운동으로 생긴 젖산 등으로 혈액 속의 H3O+의 농도가 증가하면, 증가한 H3O+이 HCO3–과 반응하여 소모되므로 혈액의 pH가 거의 일정하게 유지된다(㉡의 역반응이 일어남). H3O+(aq)+HCO3–(aq) → H2CO3(aq)+H2O(l)이때 증가한 H2CO3은 CO2와 H2O로 분해되며 CO2는 호흡으로 몸 밖으로 배출된다(㉠의 역반응이 일어남). H2CO3(aq) → CO2(g)+H2O(l)
⇨ 혈액 속 OH–의 농도 증가:혈액 속의 OH–의 농도가 증가하면 증가한 OH–이 H2CO3과 반응하여 소모되므로 혈액의 pH가 거의 일정하게 유지된다.
H2CO3(aq)+OH–(aq) → HCO3–(aq)+H2O(l)
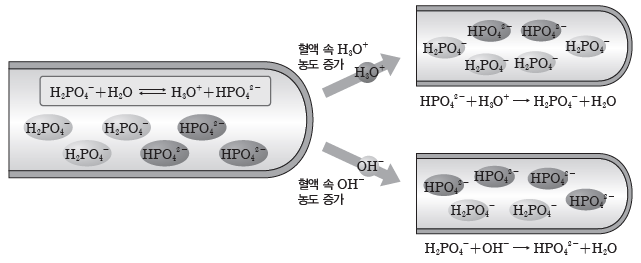
③ H2PO4–과 HPO42-의 완충 용액:혈액 속의 H2PO4–과 HPO42-의 완충 작용도 혈액의pH 조절에 영향을 미치며 두 이온은 혈액 속에서 다음과 같은 평형을 이룬다.
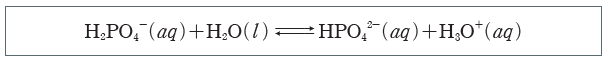
⇨ 혈액 속 H3O+의 농도 증가:혈액 속 H3O+의 농도가 증가하면, 증가한 H3O+이 HPO42-과 반응하여 소모되므로 혈액의 pH가 거의 일정하게 유지된다.
⇨ 혈액 속 OH–의 농도 증가:혈액 속의 OH–의 농도가 증가하면 증가한 OH–이 H2PO4–과 반응하여 소모되므로 혈액의 pH가 거의 일정하게 유지된다.
참고자료: EBS 수능 특강 화학2