반응 엔탈피
⑴ 반응열
① 반응물과 생성물이 가지고 있는 에너지가 다르기 때문에 화학 반응이 일어나면 항상 에너지의 출입이 뒤따른다. 화학 반응이 일어날 때 방출하거나 흡수하는 열을 반응열이라고 한다.
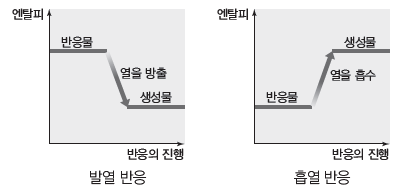
② 발열 반응:화학 반응이 일어날 때 열을 방출하는 반응으로 발열 반응이 일어나면 주위의 온도가 높아진다.
③ 흡열 반응:화학 반응이 일어날 때 열을 흡수하는 반응으로 흡열 반응이 일어나면 주위의 온도가 낮아진다.
⑵ 엔탈피(H)
① 엔탈피:특정 온도와 압력에서 어떤 물질이 가지는 고유한 에너지이며, 기호 H로 나타낸다.
② 반응의 진행에 따른 발열 반응과 흡열 반응의 열의 출입
⑶ 엔탈피 변화(ΔH)와 반응 엔탈피
① 일정한 압력에서 화학 반응이 일어나면 물질의 종류와 상태, 엔탈피가 달라지므로 반응물과 생성물의 엔탈피 차에 해당하는 열이 출입한다.
② 어떤 물질의 엔탈피(H)의 절대량을 직접 측정할 수는 없으나, 화학 반응이 진행되는 동안 출입하는 반응열을 측정하면 엔탈피 변화(ΔH)를 알 수 있다.
③ 일정한 압력에서 화학 반응이 일어날 때의 엔탈피 변화를 반응 엔탈피(ΔH)라고 한다. 반응엔탈피(ΔH)는 생성물의 엔탈피 합에서 반응물의 엔탈피 합을 뺀 값으로 나타낸다.

⑷ 발열 반응과 흡열 반응
① 발열 반응:반응물의 엔탈피 합이 생성물의 엔탈피 합보다 커서 반응이 일어날 때 엔탈피 차에 해당하는 열을 방출하는 반응이다.
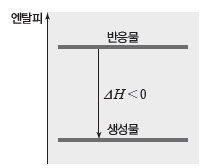
- 엔탈피 변화(ΔH)가 0보다 작은 반응으로, 발열 반응이 일어나면 주위의 온도가 높아진다.
- 발열 반응에서는 엔탈피가 감소하므로 반응 엔탈피(ΔH) 부호가 (-)이다. ⇨ ∑H반응물>∑H생성물 ∴ ΔH<0
예) C(s, 흑연)+O2(g) → CO2(g) ΔH=-393.5 kJ
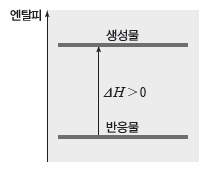
② 흡열 반응:반응물의 엔탈피 합이 생성물의 엔탈피 합보다 작아서 반응이 일어날 때 엔탈피 차에 해당하는 열을 흡수하는 반응이다.
- 엔탈피 변화(ΔH)가 0보다 큰 반응으로, 흡열 반응이 일어나면 주위의 온도가 낮아진다.
- 흡열 반응에서는 엔탈피가 증가하므로 반응 엔탈피(ΔH)부호가 (+)이다. ⇨ ∑H반응물<∑H생성물 ∴ ΔH>0
예) N2(g)+O2(g) → 2NO(g) ΔH=180.6 kJ
열화학 반응식
⑴ 열화학 반응식
① 화학 반응이 일어날 때 출입하는 반응열은 반응 엔탈피(ΔH)로 나타내며, 화학 반응식과 반응 엔탈피를 함께 나타낸 식을 열화학 반응식이라고 한다.
② 열화학 반응식은 반응물과 생성물의 에너지 관계와 화학 반응에서 출입하는 열에너지에 대한 정보를 알려준다.
- C(s, 흑연) 1 mol이 O2 (g) 1 mol과 반응하여 CO2(g) 1 mol이 생성되는 화학 반응식에서 반응 엔탈피(ΔH)가 –393.5 kJ이라면, 이 반응의 열화학 반응식은 다음과 같다.
C(s, 흑연)+O2(g) → CO2(g) ΔH=-393.5 kJ
⇨ 반응 엔탈피 부호가 (-)이므로 발열 반응이고, C(s, 흑연) 1 mol이 연소할 때 393.5 kJ의 열이 방출된다는 것을 알 수 있다.
- CaCO3(s) 1 mol이 CaO(s) 1 mol과 CO2(g) 1 mol로 분해되는 화학 반응식에서 반응 엔탈피(ΔH)가 177.8 kJ이라면, 이 반응의 열화학 반응식은 다음과 같다.
CaCO3(s) → CaO(s)+CO2(g) ΔH=177.8 kJ
⇨ 반응 엔탈피 부호가 (+)이므로 흡열 반응이고, CaCO3(s) 1 mol이 분해될 때 177.8 kJ의 열이 흡수된다는 것을 알 수 있다.
⑵ 열화학 반응식을 나타내는 방법
① 물질의 상태에 따라 엔탈피가 달라지므로 물질의 상태를 반드시 표시해야 한다. 고체는 (s), 액체는 (l), 기체는 (g), 수용액은 (aq)로 나타낸다.
예) 수소 기체(H2(g))와 산소 기체(O2(g))가 반응하여 수증기(H2O(g)) 1 mol이 생성될 때의 반응 엔탈피는 ΔH=-241.8 kJ이고, 물(H2O(l)) 1 mol이 생성될 때의 반응 엔탈피는 ΔH=-285.8 kJ이다.
H2(g)+1/2O2(g) → H2O(g) ΔH=-241.8 kJ
H2(g)+1/2O2(g) → H2O(l) ΔH=-285.8 kJ
② 열화학 반응식에는 온도와 압력을 함께 표시한다. 온도와 압력 조건이 주어지지 않으면 일반적으로 25℃, 1 atm이다.
③ 같은 화학 반응이라도 반응 계수에 따라 반응 엔탈피가 달라진다. 반응 엔탈피는 물질의 양(mol)에 비례하므로 열화학 반응식에서 반응 계수가 달라지면 반응 엔탈피도 달라진다.
예) H2O(g) 2 mol이 생성될 때의 반응 엔탈피(ΔH)는 1 mol이 생성될 때의 2배이다.
H2(g)+1/2O2(g) → H2O(g) ΔH=-241.8 kJ
2H2(g)+O2(g) → 2H2O(g) ΔH=-483.6 kJ
④ 역반응의 반응 엔탈피(ΔH)는 정반응의 반응 엔탈피(ΔH)와 절댓값은 같고, 부호는 반대이다.
예) H2O(g) 1 mol이 생성되는 반응과 분해되는 반응에서 반응 엔탈피(ΔH)는 절댓값이 같고 부호는 반대이다.
H2(g)+1/2O2(g) → H2O(g) ΔH=-241.8 kJ
H2O(g) → H2(g)+1/2O2(g) ΔH=241.8 kJ
생성 엔탈피
⑴ 생성 엔탈피
① 어떤 물질 1 mol이 성분 원소의 가장 안정한 원소로부터 생성될 때의 반응 엔탈피이다.
② 1 atm에서의 생성 엔탈피를 표준 생성 엔탈피라고 하며 단위는 kJ/mol이다.
예) 1/2N2(g)+1/2O2(g) → NO(g) ΔH=90.3 kJ
⇨ NO(g)의 표준 생성 엔탈피(ΔH)=90.3 kJ/mol
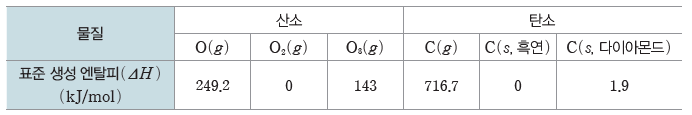
[몇 가지 물질의 표준 생성 엔탈피(ΔH)]

⇨ CO2(g)의 표준 생성 엔탈피(ΔH)=-393.5 kJ/mol이고, 탄소와 산소의 가장 안정한 원소는 각각 C(s, 흑연)과 O2(g)이므로 이를 열화학 반응식으로 나타내면 다음과 같다.
C(s, 흑연)+O2(g) → CO2(g) ΔH=-393.5 kJ
⇨ C2H4(g)의 표준 생성 엔탈피(ΔH)=52.5 kJ/mol이고, 탄소와 수소의 가장 안정한 원소는 각각 C(s, 흑연)과 H2(g)이므로 이를 열화학 반응식으로 나타내면 다음과 같다.
2C(s, 흑연)+2H2(g) → C2H4(g) ΔH=52.5 kJ
③ 원소의 표준 생성 엔탈피(ΔH):표준 상태에서 원소에 여러 가지 동소체가 존재하는 경우가장 안정한 물질의 표준 생성 엔탈피는 0이다. 산소의 동소체에는 O2(g)와 O3(g)이 존재하는데, 가장 안정한 원소는 O2(g)이므로 O2(g)의 표준 생성 엔탈피가 0이다. 또한 탄소는 흑연, 다이아몬드, 풀러렌 등의 동소체가 존재하며, 이 중 가장 안정한 원소는 흑연이므로 흑연의 표준 생성 엔탈피는 0이다.
⑵ 간이 열량계를 이용한 반응열의 측정
① 발생하거나 흡수한 열에너지를 열량계 속의 수용액이 모두 흡수하거나 방출한다고 가정한다.
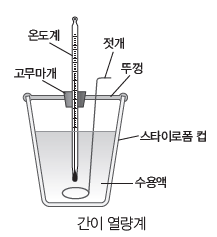
② 반응 과정에서 발생한 열에너지
=수용액이 흡수한 열에너지(Q)=c수용액×m수용액×Δt
- 비열(c):물질 1 g의 온도를 1℃ 높이는 데 필요한 열에너지로 단위는 J/(g·℃)이다.
- m수용액:수용액의 질량(g)
- Δt:수용액의 온도 변화(℃)=t반응 후-t반응 전
③ 반응열을 간단하게 측정할 수 있으나, 반응열의 일부가 열량계 등 실험 기구의 온도를 변화시키는 데 쓰이거나 열량계 바깥과 열 교환이 일어나 오차가 발생한다.
결합 에너지와 반응 엔탈피
⑴ 결합 에너지
① 화학 반응에서는 반응물을 이루는 원자 사이의 결합이 끊어지고 새로운 결합이 형성되면서 생성물을 만드는데, 이때 원자 사이의 결합이 끊어질 때에는 에너지가 흡수되고 생성될 때에는 에너지가 방출된다.
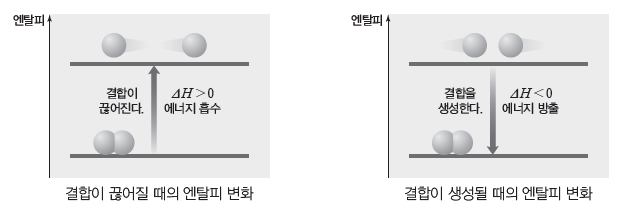
② 결합 에너지:기체 상태의 물질을 구성하는 두 원자 사이의 공유 결합 1 mol을 끊어 기체상태의 원자로 만드는 데 필요한 에너지이다.
- 결합을 끊으려면 에너지를 흡수해야 하므로 결합 에너지는 항상 (+)값을 갖는다.
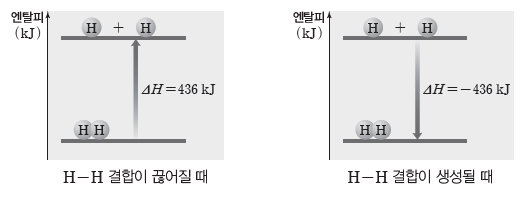
예) H-H의 결합 에너지:기체 상태의 수소 분자(H2) 1 mol이 분자 내 결합이 끊어져 기체 상태의 수소 원자(H)로 될 때 436 kJ의 에너지가 필요하므로 H-H의 결합 에너지는 436 kJ/mol이다.
H2(g) → H(g)+H(g) ΔH=436 kJ
③ 결합 에너지와 결합의 세기
- 원자 사이의 결합력이 클수록 결합을 끊기 어려우므로 결합 에너지는 원자 사이의 결합이 강할수록 크다.
예) H2(g) → H(g)+H(g) ΔH=436 kJ
Cl2(g) → Cl(g)+Cl(g) ΔH=243 kJ
⇨ H-H의 결합 에너지(436 kJ/mol)는 Cl-Cl의 결합 에너지(243 kJ/mol)보다 크므로 결합의 세기는 H-H 결합이 Cl-Cl 결합보다 강하다.
- 같은 원자 사이의 결합이라도 공유 전자쌍 수가 증가할수록 결합 에너지가 증가한다.
예) 결합 에너지 : C≡C>C=C>C-C, N≡N>N=N>N-N
- C-H의 결합 에너지는 메테인(CH4)과 에테인(C2H6)에서 다르다. 이와 같이 다원자 분자에서 같은 원자 사이의 결합이라도 조건에 따라 결합 에너지가 다르게 나타나므로 이때 결합 에너지는 평균값으로 나타낸다.
[몇 가지 결합의 결합 에너지]
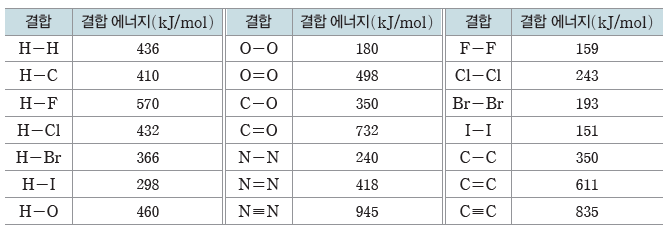
※ 단, CO2(g)에서 C=O의 결합 에너지는 799 kJ/mol이다.
⑵ 결합 에너지로부터 반응 엔탈피(ΔH) 구하기
① 결합이 끊어질 때 에너지를 흡수(ΔH>0)하고, 결합이 생성될 때 에너지를 방출(ΔH<0)한다. 그러므로 기체 반응은 반응물의 결합이 끊어져 원자 상태로 되고(1단계), 원자들이 결합하여 생성물이 되는(2단계) 2개의 단계로 생각할 수 있다.
예) 수소(H2(g))와 염소(Cl2(g))로부터 염화 수소(HCl(g))가 생성될 때의 반응 엔탈피(ΔH) 구하기
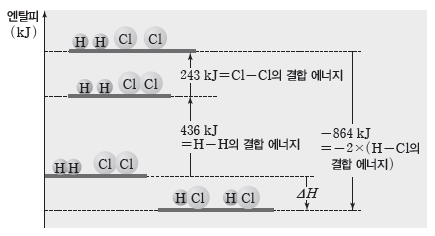
[1단계] 반응물의 결합이 끊어지는 과정
H2(g)+Cl2(g) → 2H(g)+2Cl(g) ΔH1=436 kJ+243 kJ=679 kJ
[2단계] 생성물의 결합이 생성되는 과정
2H(g)+2Cl(g) → 2HCl(g) ΔH2=-2×432 kJ=-864 kJ
- 반응 엔탈피(ΔH):전체 반응은 1단계와 2단계 반응의 합이다.
ΔH=ΔH1+ΔH2=679 kJ+(-864 kJ)=-185 kJ
② 기체 반응에서 반응 엔탈피(ΔH)는 반응물의 결합이 끊어질 때 흡수하는 에너지(반응물의 결합 에너지 총합)에서 생성물의 결합이 생성될 때 방출하는 에너지(생성물의 결합 에너지 총합)를 뺀 값이다.

헤스 법칙
⑴ 헤스 법칙:화학 반응이 일어나는 동안에 반응물의 종류와 상태, 생성물의 종류와 상태가같으면 반응 경로에 관계없이 반응 엔탈피의 총합은 일정하다. 이를 헤스 법칙이라고 한다.
① 탄소의 연소 반응
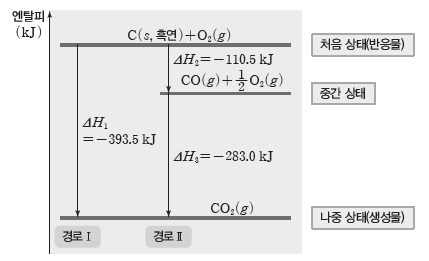
- 경로Ⅰ : 탄소가 연소하여 직접 이산화 탄소로 되는 과정
C(s, 흑연)+O2(g) → CO2(g) ΔH1=-393.5 kJ
- 경로Ⅱ:탄소가 연소하여 일산화 탄소로 되었다가 이산화 탄소로 되는 과정
C(s, 흑연)+1/2O2(g) → CO(g) ΔH2=-110.5 kJ
CO(g)+1/2O2(g) → CO2(g) ΔH3=-283 kJ
- 경로Ⅱ의 반응 엔탈피의 합은 ΔH2+ΔH3=-110.5 kJ+(-283 kJ)=-393.5 kJ로 경로Ⅰ의 반응 엔탈피 ΔH1=-393.5 kJ과 같다. 따라서 처음 물질(반응물)과 나중 물질(생성물)의 종류와 상태가 같으면 반응 경로에 관계없이 출입하는 에너지는 같다.
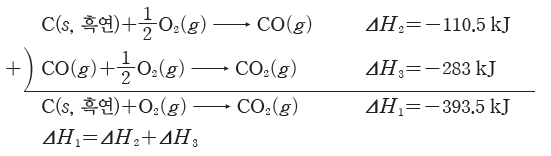
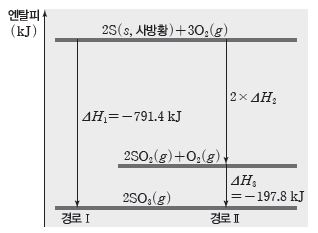
② 황의 연소 반응
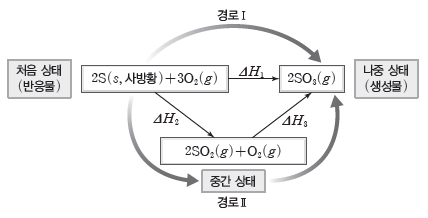
- 경로Ⅰ : 황이 연소되어 직접 삼산화 황으로 되는 과정
2S(s, 사방황)+3O2(g) → 2SO3(g) ΔH1
- 경로Ⅱ : 황이 이산화 황이 되었다가 삼산화 황으로 되는 과정
2S(s, 사방황)+2O2(g) → 2SO2(g) ΔH2
2SO2(g)+O2(g) → 2SO3(g) ΔH3
- S(s, 사방황)은 경로Ⅰ을 통해 바로 SO3(g)이 될 수도, 경로Ⅱ를 통해 SO2(g)이 되었다가 SO3(g)이 될 수도 있다.
- 경로Ⅰ과 경로Ⅱ의 처음 상태는 모두 S(s, 사방황), O2(g)이고, 나중 상태는 모두 SO3(g)으로 같다.
- 경로Ⅰ의 반응 엔탈피와 경로Ⅱ의 반응 엔탈피의 합이 같다. ⇨ ΔH1=ΔH2+ΔH3
⑵ 헤스 법칙의 이용:화학 반응의 반응 엔탈피를 직접 측정하기 어려운 경우 헤스 법칙을 이용한다.
① 구하고자 하는 반응의 열화학 반응식을 적는다.
② 주어지거나 변형한 열화학 반응식을 더하거나 빼서 반응 엔탈피를 구한다.
예) 헤스 법칙을 이용한 이산화 황(SO2(g))의 생성 엔탈피(ΔH) 구하기

⇨ 경로 Ⅰ의 반응 엔탈피와 경로 Ⅱ의 반응 엔탈피의 합이 같으므로 ΔH1=2×ΔH2+ΔH3에서 ΔH2=1/2(ΔH1-ΔH3)이다.
따라서 ΔH2=1/2(-791.4 kJ-(-197.8 kJ))=-296.8 kJ이므로 SO2(g)의 생성 엔탈피(ΔH)는 –296.8 kJ/mol이다.
참고자료: EBS 수능특강 화학2