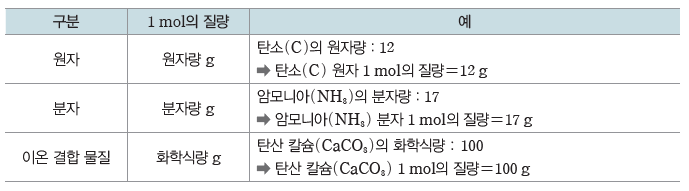
화학식량
물질을 원소 기호를 이용하여 표현하는 것을 통틀어 화학식이라고 한다. 화학식량은 물질의 화학식을 이루는 원자의 원자량을 모두 더하여 구한다.
(1) 원자량:질량수가 12인 탄소(12C) 원자의 원자량을 12로 정하고, 이것을 기준으로 하여 비교한 원자의 상대적인 질량이며, g, kg과 같은 단위를 붙이지 않는다.
- 질량수:양성자수와 중성자수를 합한 수이다.
예) 12C:양성자수가 6, 중성자수가 6이므로 질량수가 12이다.
※ 원자량을 사용하는 까닭:원자 1개의 실제 질량은 매우 작아서 원자 1개의 질량을 직접 측정하기 어렵고, 실제 질량을 그대로 사용하면 매우 불편하다. 그래서 특정 원자와 비교한 상대적 질량인 원자량을 사용한다.
(2) 분자량:분자의 상대적인 질량을 나타내는 값으로, 분자를 구성하는 모든 원자들의 원자량 을 합한 값이다. 분자량도 상대적인 질량이므로 단위가 없다.
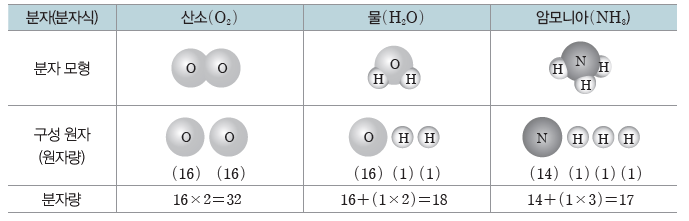
(3) 분자가 아닌 물질의 화학식량
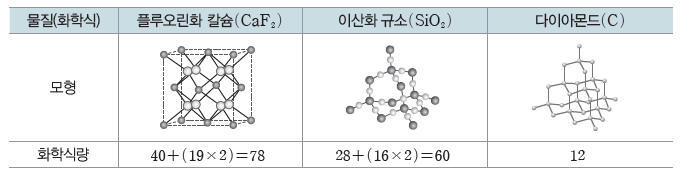
① 염화 나트륨(NaCl), 염화 칼슘(CaCl2) 등의 이온 결합 물질과 철(Fe), 구리(Cu) 등의 금속 결합 물질, 그리고 공유 결합 물질 중 이산화 규소(SiO2), 다이아몬드(C) 등은 분자가 아니다.
② 분자가 아닌 물질의 화학식량은 화학식을 이루는 각 원자의 원자량을 합하여 구한다.
- 염화 나트륨은 Na+과 Cl–이 1 : 1의 개수비로 연속적으로 결합하여 결정을 이루고 있어서 화학식을 NaCl로 표시하며 화학식량은 화학식을 구성하는 원자의 원자량을 합하여 구한다.
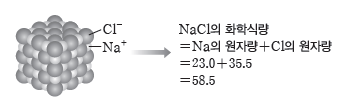
몰
(1) 몰
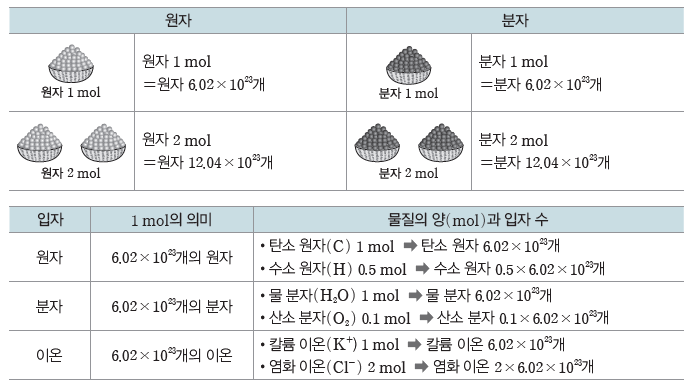
① 몰(mol):원자, 분자, 이온 등과 같은 입자의 수를 나타낼 때 사용하는 묶음 단위이다.
- 묶음 단위를 사용하는 까닭:원자, 분자, 이온은 매우 작고 가벼워서 물질의 양이 적어도 그 속에 들어 있는 원자, 분자, 이온 수가 매우 많기 때문에 묶음 단위를 사용하면 편리하다.
② 몰과 아보가드로수(NA):1 mol은 6.02×1023개의 입자를 뜻하며, 6.02×1023을 아보가드로수라고 한다.

(2) 몰과 입자 수:원자, 분자, 이온 등 입자의 종류와 관계없이 입자 1 mol에는 그 입자가 6.02×1023개 들어 있다.
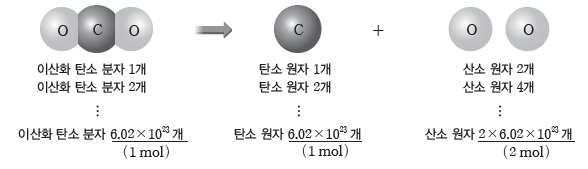
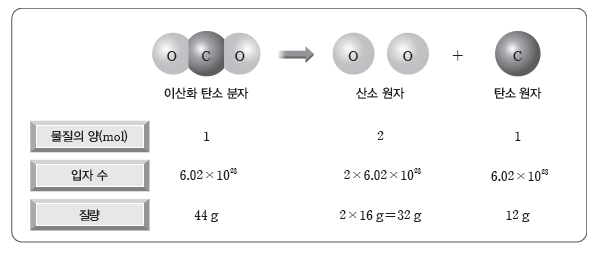
① 분자로 이루어진 물질의 양(mol)을 알면 그 물질을 구성하는 원자의 양(mol)과 개수를 알 수 있다.
예) 이산화 탄소(CO2) 분자 1 mol에는 탄소(C) 원자 1 mol, 산소(O) 원자 2 mol이 들어있다.
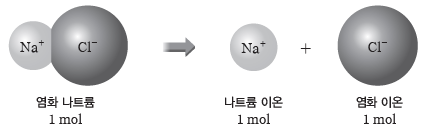
② 이온 결합 물질의 양(mol)을 알면 그 물질을 구성하는 이온의 양(mol)을 알 수 있다.
예) 염화 나트륨(NaCl) 1 mol에는 Na+ 1 mol과 Cl– 1mol이 들어 있으므로 총 2 mol의 이온이 들어 있다.
(3) 몰과 질량
① 1 mol의 질량:물질의 화학식량 뒤에 그램(g) 단위를 붙인 질량이다.
- 이산화 탄소(CO2) 분자와 구성 원자의 몰과 질량 관계
② 물질의 질량 구하기:물질의 질량은 1 mol의 질량에 물질의 양(mol)을 곱하여 구한다.

예) 물(H2O) 2 mol의 질량=18 g/mol×2 mol=36 g
③ 물질의 양(mol) 구하기:물질의 양(mol)은 물질의 질량을 그 물질 1 mol의 질량으로 나누어 구한다.
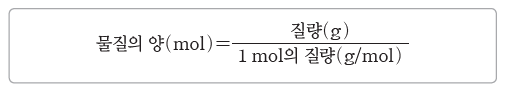
예) 물(H2O) 54 g의 양(mol)=54g/18g/mol=3 mol
④ 물질 1 g에 포함된 양(mol)과 구성 원자의 개수비, 질량비

- 같은 질량의 물질에 포함된 분자 수는 분자량에 반비례한다.
예) 1 g의 메테인(CH4)과 1 g의 이산화 탄소(CO2)에 포함된 분자 수비
CH4 : CO2=1/16:1/44=11:4
(4) 몰과 기체의 부피
① 아보가드로 법칙:모든 기체는 같은 온도와 압력에서 같은 부피 속에 같은 수의 분자가 들어있다.
② 기체 1 mol의 부피:0℃, 1 atm에서 모든 기체 1 mol의 부피는 22.4 L로 일정하며, 기체 22.4 L 속에는 6.02×1023개의 기체 분자가 들어있다.
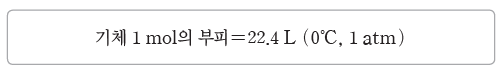
③ 기체의 부피와 분자의 양(mol):기체 분자의 양(mol)은 기체의 부피를 기체 1 mol의 부피로 나누어 구한다.

예) 20℃, 1 atm에서 기체 1 mol의 부피가 24 L일 때, 20℃, 1 atm에서 메테인(CH4) 기체 12 L에 포함된 기체 분자의 양은 12 L/(24 L/mol)=0.5 mol이다.
④ 기체의 밀도와 분자량:같은 온도와 압력에서 같은 부피의 기체에 포함된 분자 수가 같고,
밀도= 질량/부피이므로 기체의 밀도는 분자량에 비례한다.
예 산소(O2)의 분자량이 32, 메테인(CH4)의 분자량이 16이므로 20℃, 1 atm에서 산소(O2) 기체의 밀도가 4/3g/L이면 메테인(CH4) 기체의 밀도는 4/3g/L×1/2=2/3g/L이다.
(5) 물질의 양(mol)과 입자 수, 질량, 기체의 부피 사이의 관계

예) C2H6(분자량:30) 기체 2 mol의 입자 수, 질량, 부피
- 분자 수:2×6.02×1023
- 질량:2×30 g
- 기체의 부피:2×22.4 L (0℃, 1 atm)
