보어의 원자 모형
(1) 수소 원자의 선 스펙트럼
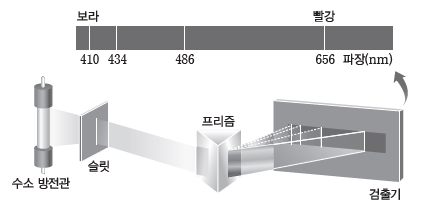
수소 기체를 방전관에 넣고 고전압으로 방전시키면 수소 방전관에서 빛이 방출되는데, 이 빛을 프리즘에 통과시키면 불연속적인 선 스펙트럼이 생긴다. 이는 전자가 에너지를 흡수하여 에너지가 높은 상태로 되었다가 다시 에너지를 방출하면서 에너지가 낮은 상태로 되기 때문이다. 이때 그 차이만큼의 에너지를 빛의 형태로 방출한다.
(2) 보어의 원자 모형
① 수소 원자의 불연속적인 선 스펙트럼을 설명하기 위하여 제안된 모형으로, 전자는 원자핵주위의 일정한 궤도를 따라 원운동하며, 불연속적인 전자의 궤도를 전자 껍질이라고 한다. 전자 껍질의 에너지 준위는 불연속적이며, 핵에 가까운 쪽에서부터 K(n=1), L(n=2), M(n=3), N(n=4)··· 등의 기호를 사용하여 나타낸다. 이때 n은 주 양자수라고 하며, 양의 정수이다.
② 수소 원자에서 전자 껍질의 에너지 준위는 주 양자수 n에 의해서만 결정된다.
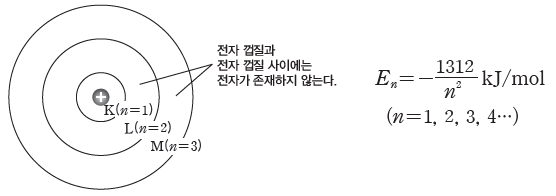
③ 원자핵에서 멀어질수록 전자 껍질의 에너지 준위는 높아지며, 인접한 두 전자 껍질 사이의에너지 간격은 좁아진다. 전자가 원자핵에 가장 가까운 전자 껍질에 존재하는 상태, 즉 에너지 준위가 가장 낮아서 안정한 상태를 바닥상태라고 하고, 전자가 에너지 준위가 높은 전자껍질로 전이되어 불안정한 상태를 들뜬상태라고 한다.
④ 전자는 같은 전자 껍질에서 원운동할 때 에너지를 흡수하거나 방출하지 않는다. 전자가 다른 전자 껍질로 전이될 때 두 전자 껍질의 에너지 차만큼의 에너지를 흡수하거나 방출한다.
⑤ 빛에너지와 파장은 반비례하므로 전자가 전이할 때 방출하는 에너지가 클수록 빛의 파장은짧고, 에너지가 작을수록 빛의 파장은 길다.
⑥ 전자가 n=3, 4, 5, 6인 전자 껍질에서 n=2인 전자 껍질로 전이할 때 가시광선의 빛이 방출된다.
현대적 원자 모형
(1) 현대적 원자 모형 등장의 배경
① 보어 모형의 한계:보어 모형은 전자가 1개인 수소 원자의 선 스펙트럼을 잘 설명할 수 있었으나, 전자가 2개 이상인 다전자 원자의 선 스펙트럼을 설명할 수 없었다.
② 전자는 질량이 매우 작아 정확한 위치와 운동량(속도)을 동시에 측정할 수 없지만, 파동의 성질을 지니므로 전자가 발견될 확률을 파동 함수로 나타낼 수 있다.
(2) 현대적 원자 모형
① 오비탈(궤도 함수):일정한 에너지를 가진 전자가 원자핵 주위에서 발견될 확률을 나타내는 함수이며, 궤도 함수의 모양, 전자의 에너지 상태를 의미하기도 한다.
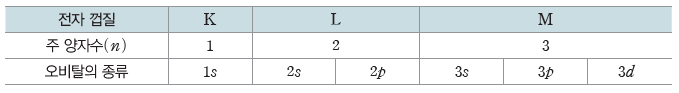
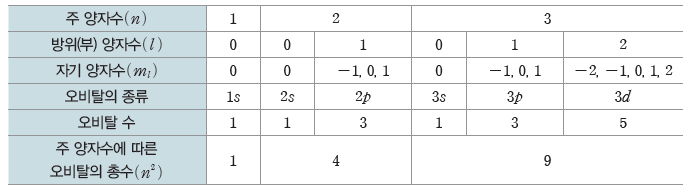
- 주 양자수(n)와 오비탈의 모양을 의미하는 s, p, d, f 등의 기호를 사용하여 나타낸다.
- 주 양자수에 따른 오비탈의 종류
② s 오비탈:공 모양(구형)으로 모든 전자 껍질에 존재하며, 전자가 발견될 확률이 90%인 공간을 경계면으로 나타내면 다음과 같다.
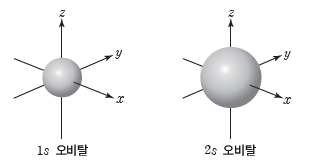
- 핵으로부터 거리가 같으면 방향에 관계없이 전자가 발견될 확률이 같다.
- 1s 오비탈과 2s 오비탈의 모양은 같지만, 같은 원자에서 2s 오비탈이 1s 오비탈보다 크기가 크다.
③ p 오비탈:아령 모양으로 L 전자 껍질(n=2)부터 존재한다.
- 방향성이 있어서 핵으로부터의 거리와 방향에 따라 전자가 발견될 확률이 다르다.
- p 오비탈은 3차원 공간의 각 축 방향으로 분포하며, 한 전자 껍질에 에너지 준위가 같은px, py, pz 오비탈이 존재한다.
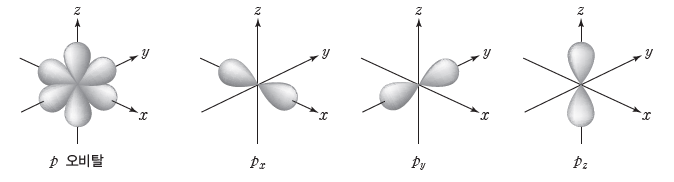
④ 오비탈의 표시

주 양자수는 2이고 오비탈의 종류는 p이며, 이 오비탈에 전자가 1개 존재한다.
⑤ 각 전자 껍질의 오비탈 수
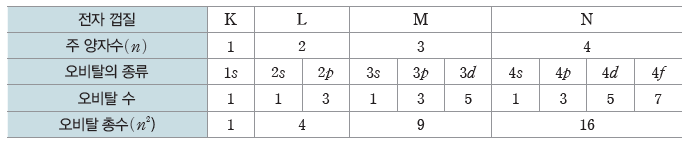
양자수
현대의 원자 모형은 오비탈의 에너지와 크기, 모양 등을 나타내기 위해 양자수라는 개념을 도입 하였으며, 주 양자수, 방위(부) 양자수, 자기 양자수, 스핀 자기 양자수가 있다.
(1) 주 양자수(n)
① 오비탈의 에너지와 크기를 결정하는 양자수이다.
② 보어 원자 모형에서 전자 껍질을 나타낸다.
③ n=1, 2, 3, 4··· 등의 양의 정숫값을 갖는다.
④ 수소 원자에서 주 양자수가 증가할수록 오비탈의 크기와 에너지 준위는 커진다.

(2) 방위(부) 양자수(l)
① 오비탈의 모양을 결정하는 양자수이다.
② 주 양자수가 n일 때 방위(부) 양자수는 0≤l≤n-1의 정숫값을 갖는다.
예)
주 양자수가 1일 때 방위(부) 양자수는 0이다.
주 양자수가 2일 때 방위(부) 양자수는 0, 1이다.
주 양자수가 3일 때 방위(부) 양자수는 0, 1, 2이다.
③ 주 양자수에 따른 방위(부) 양자수와 오비탈의 종류
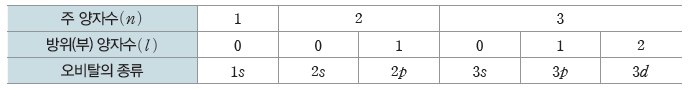
④ 다전자 원자에서는 주 양자수가 같을 때 방위(부) 양자수가 클수록 오비탈의 에너지 준위가 높다.
(3) 자기 양자수(ml)
① 오비탈의 공간적인 방향을 결정하는 양자수이다.
② 방위(부) 양자수가 l일 때 자기 양자수는 –l≤ml≤l의 정숫값을 갖는다.
예) 방위(부) 양자수(l)가 1일 때 자기 양자수(ml)는 -1, 0, 1이고, 이는 방위(부) 양자수가 1인 오비탈이 3개임을 의미한다.
③ 방위(부) 양자수가 l인 오비탈 수는 (2l+1)이고, 각각 방향은 다르지만 에너지 준위는 같다.
④ 양자수에 따른 오비탈의 종류와 수
(4) 스핀 자기 양자수(ms)
① 외부에서 자기장을 걸어 주었을 때, 전자의 자기 상태가 서로 반대 방향으로 나누어지는 것과 관련된 양자수이다.
② 스핀 자기 양자수는 +1/2, -1/2의 2가지가 가능하며 스핀 자기 양자수가 다른 전자는 ↑, ↓와 같이 서로 반대 방향의 화살표를 사용하여 표시한다.
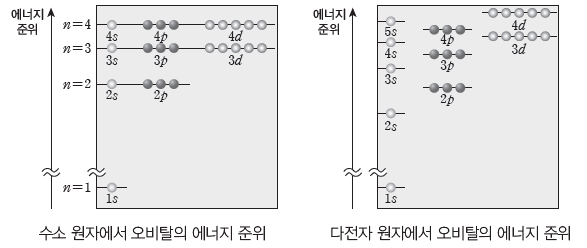
오비탈의 에너지 준위
오비탈의 에너지 준위는 전자가 1개인 수소 원자와 전자가 2개 이상인 다전자 원자에서 서로 다르다.
(1) 수소 원자
① 전자가 1개인 수소 원자의 경우 오비탈의 에너지 준위는 오비탈의 종류에 관계없이 주 양자수에 의해서만 결정된다.
② 주 양자수가 커질수록 원자핵에서 전자가 멀어지므로 원자핵과의 인력이 약해져 에너지 준위가 높아진다.

(2) 다전자 원자
전자가 2개 이상인 원자의 경우 오비탈의 에너지 준위는 주 양자수뿐만 아니라 오비탈의 종류에 따라서도 달라진다. 즉, 주 양자수가 같아도 s, p, d, f 순으로 에너지 준위가 높아진다.
![]()
현대적 원자 모형에 따른 전자 배치
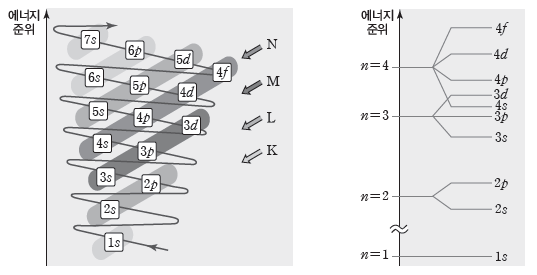
(1) 쌓음 원리
전자는 에너지 준위가 낮은 오비탈부터 순서대로 채워진다.
① 전자가 1개인 수소 원자의 경우 오비탈의 에너지 준위는 오비탈의 종류에 관계없이 주 양자수에 의해서만 결정된다. 1s<2s=2p<3s=3p=3d<···
② 전자가 2개 이상인 다전자 원자의 경우에는 주 양자수뿐만 아니라 오비탈의 종류에 따라서도 에너지 준위가 달라진다. 1s<2s<2p<3s<3p<4s<3d<···
③ 다전자 원자의 전자 배치 순서
(2) 파울리 배타 원리
1개의 오비탈에는 전자가 최대 2개까지 채워지며, 이 두 전자는 서로 다른 스핀 자기 양자수를 갖는다.
① 1개의 오비탈에는 스핀 자기 양자수가 같은 전자가 존재할 수 없으며, 스핀 자기 양자수가다른 2개의 전자가 쌍을 이루면서 함께 존재할 수 있다.
② 1개의 오비탈에 3개 이상의 전자가 들어가거나 스핀 자기 양자수가 같은 2개의 전자가 들어가는 것은 파울리 배타 원리에 어긋나는 전자 배치로, 불가능한 전자 배치이다.
예) 베릴륨(Be)의 전자 배치

Be의 2s 오비탈에 배치된 전자 2개는 주 양자수가 각각 2, 방위(부) 양자수는 각각 0, 자기 양자수는 각각 0으로 같지만, 스핀 자기 양자수는 각각 +1/2, -1/2로 다르다. 따라서 두 전자의 (주 양자수, 방위(부) 양자수, 자기 양자수, 스핀 자기 양자수)를 나타내면 각각 (2, 0, 0, +1/2), (2, 0, 0, -1/2)이다.
(3) 훈트 규칙
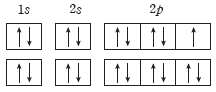
에너지 준위가 같은 오비탈이 여러 개 있을 때 쌍을 이루지 않는 전자(홀전자) 수가 최대가 되도록 전자가 배치된다.
① p 오비탈처럼 에너지 준위가 같은 오비탈이 여러 개 있을 때 각 오비탈에 전자가 먼저 1개씩 배치된 후, 다음 전자가 쌍을 이루면서 배치된다.
② 전자들이 1개의 오비탈에 쌍을 이루어 들어가는 것보다 에너지 준위가 같은 여러 개의 오비탈에 1개씩 들어가는 것이 전자 간의 반발력이 작아서 더 안정하다.
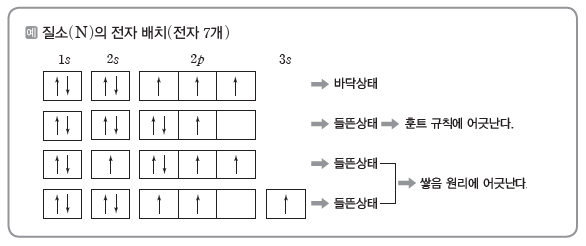
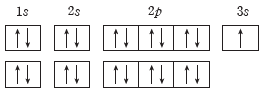
예) 탄소(C)의 전자 배치:2p 오비탈에 있는 전자가 2개이므로 홀전자 수가 2인 (나)가 (가)보다 안정하다. (나)가 안정한 바닥상태의 전자 배치이고, (가)는 (나)보다 불안정한 들뜬 상태 전자 배치이다.
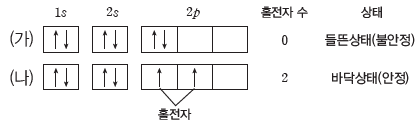
(4) 바닥상태와 들뜬상태
① 바닥상태 전자 배치는 쌓음 원리, 파울리 배타 원리, 훈트 규칙을 모두 만족한다.
② 들뜬상태 전자 배치는 파울리 배타 원리를 반드시 만족해야 하지만 쌓음 원리 또는 훈트 규칙을 만족할 필요는 없다.
전자 껍질에 따른 전자 배치
(1) 전자 껍질과 전자 배치
① 수소 원자에서 전자 껍질의 에너지 준위는 주 양자수(n)가 커질수록 높아진다.
K<L<M<N<···
② 각 전자 껍질에는 최대 2n2개의 전자가 채워질 수 있다. 각 전자 껍질에는 n2개의 오비탈이 존재하며, 1개의 오비탈에는 최대 2개의 전자가 채워지기 때문이다.
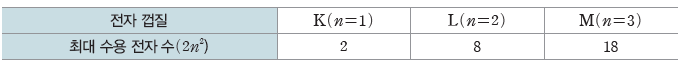
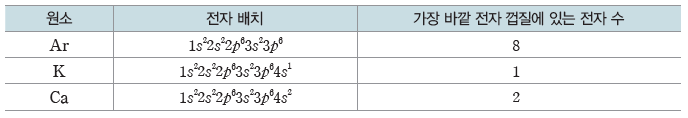
③ 원자 번호가 1~20인 원자의 바닥상태 전자 배치에서 가장 바깥 전자 껍질의 전자 수는 8을넘지 못한다. 3p 오비탈에 전자가 채워지고 나면, 3d 오비탈에 전자가 배치되기 전에 바깥 전자 껍질의 4s 오비탈에 전자가 먼저 배치되기 때문이다.
(2) 원자가 전자
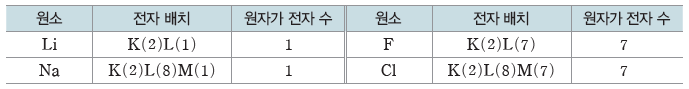
① 바닥상태의 전자 배치에서 화학 결합에 관여하는 가장 바깥 전자 껍질에 있는 전자로 원소의 화학적 성질을 결정한다.
② 원자가 전자 수가 같은 원소는 화학적 성질이 비슷하다.
이온의 전자 배치
(1) 양이온의 전자 배치
원자가 가장 바깥 전자 껍질의 전자를 모두 잃고 양이온이 되면 전자 배치가 비활성 기체의 전자 배치와 같아진다.
예) 나트륨 원자가 전자를 1개 잃어 양이온이 되면 전자 배치가 네온의 전자 배치와 같아진다.
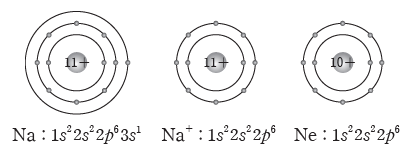
•나트륨(Na) 원자의 전자 배치:
•나트륨 이온(Na+)의 전자 배치:
(2) 음이온의 전자 배치
원자가 전자를 얻어 가장 바깥 전자 껍질의 전자가 8개인 음이온이 되면 전자 배치가 비활성기체의 전자 배치와 같아진다.
예) 플루오린 원자가 전자를 1개 얻어 음이온이 되면 전자 배치가 네온의 전자 배치와 같아진다.
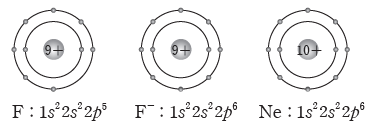
- 플루오린(F) 원자의 전자 배치:
- 플루오린화 이온(F–)의 전자 배치: