충돌 횟수와 반응 속도
⑴ 농도와 반응 속도
일반적으로 온도가 일정할 때 반응물의 농도가 증가하면 단위 부피당 입자 수가 증가하여 입자 간의 충돌 횟수가 증가하므로 반응 속도가 빨라진다.
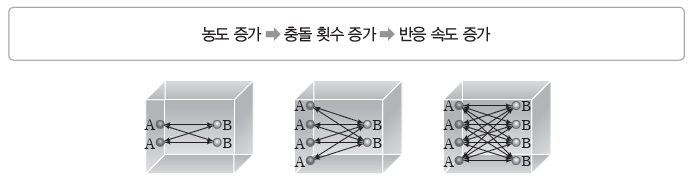
예) 농도에 따라 반응 속도가 변하는 경우
- 강철솜은 공기 중에서보다 산소가 든 집기병에서 빠르게 연소된다.
- 탄산 칼슘과 염산의 반응에서 염산의 농도가 증가할수록 반응 속도가 빨라진다.
⑵ 기체의 압력과 반응 속도
온도가 일정할 때 기체 사이의 반응에서 기체의 부분 압력이 증가하면 단위 부피당 기체 분자 수가 증가하여 충돌 횟수도 증가하므로 반응 속도가 빨라진다.
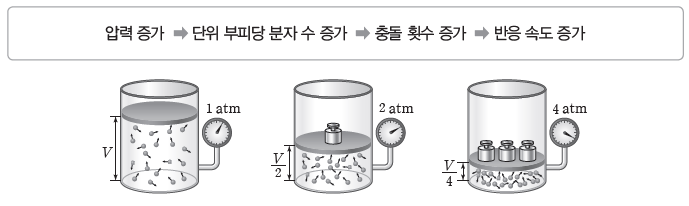
⑶ 표면적과 반응 속도
온도가 일정할 때 반응물이 고체인 경우 표면적이 넓어 반응물 사이의 접촉 면적이 커지면 충돌 횟수가 증가하여 반응 속도가 빨라진다.
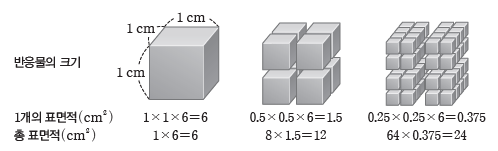
예) 표면적에 따라 반응 속도가 변하는 경우
- 미세 먼지가 많은 탄광이나 밀가루 공장에서 폭발 사고가 일어나기 쉽다.
- 알약보다 가루약의 흡수가 더 빠르다.
온도와 반응 속도
⑴ 온도와 반응 속도
온도가 높아지면 분자들의 평균 운동 에너지가 증가하고, 활성화 에너지(Ea) 이상의 에너지를 갖는 분자 수가 증가한다. 따라서 온도가 높아지면 반응이 가능한 분자 수가 증가하여 반응 속도가 빨라진다.
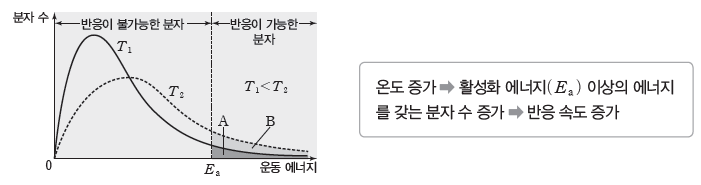
① 온도가 T1에서 T2로 높아져도 전체 분자 수는 변하지 않는다.
② 온도가 T1에서 T2로 높아져도 화학 반응의 활성화 에너지(Ea)는 변하지 않지만, 활성화 에너지 이상의 에너지를 갖는 분자 수는 온도 T1일 때 A에서 온도 T2일 때 (A+B)로 증가하므로 반응 속도는 T1에서보다 T2에서 빠르다.
⑵ 반응 속도 상수와 온도
온도가 높아지면 반응 속도가 빨라진다. 이는 반응 속도식에서 반응 속도 상수(k)의 값이 커지기 때문이며, 온도가 높아지면 정반응 속도와 역반응 속도가 모두 빨라진다.
예) 온도에 따라 반응 속도가 변하는 경우
- 겨울철에도 온실에서는 식물이 잘 자란다.
- 음식물을 냉장고에 보관하면 실온에서보다 오랫동안 보관할 수 있다.
촉매와 반응 속도
⑴ 촉매:화학 반응에서 자신은 소모되지 않으면서 반응 속도를 빠르게 또는 느리게 하는 물질이다. 촉매를 사용하면 반응의 활성화 에너지의 크기가 변하여 반응 속도가 달라진다.

⑵ 촉매의 종류
① 정촉매:활성화 에너지의 크기를 감소시켜 반응할 수 있는 분자 수가 증가하므로 반응 속도가 빨라진다.
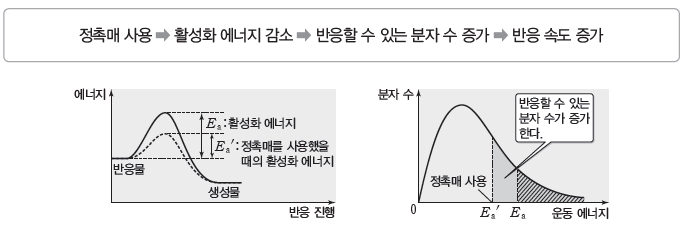
예) 과산화 수소수에 이산화 망가니즈를 넣으면 과산화 수소가 물과 산소로 분해되는 속도가 빨라진다.
② 부촉매:활성화 에너지의 크기를 증가시켜 반응할 수 있는 분자 수가 감소하므로 반응 속도가 느려진다.
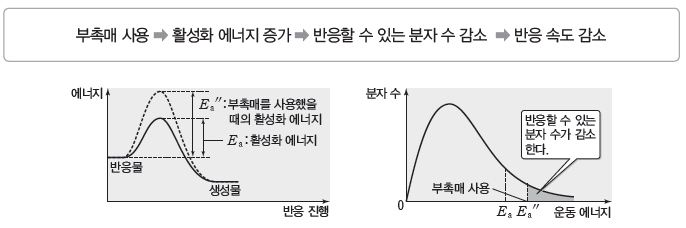
예) 과산화 수소수에 인산을 넣으면 과산화 수소의 분해 반응 속도가 느려진다.
③ 촉매의 특징
- 촉매는 활성화 에너지의 크기를 변화시키므로 정반응 속도와 역반응 속도를 모두 변화시킨다.
- 촉매를 사용해도 활성화 에너지의 크기만 달라지고, 반응물과 생성물의 에너지는 달라지지 않는다. 따라서 촉매를 사용해도 반응 엔탈피(ΔH)는 변하지 않는다.
생명 현상과 산업 현장에서 촉매의 이용
⑴ 효소의 작용
① 효소:생물체 내에서 일어나는 여러 가지 화학 반응에서 촉매 역할을 하는 물질이다.
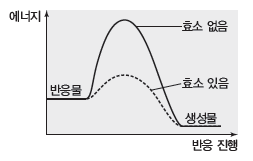
예) 2H2O2(l) → 2H2O(l)+O2(g)의 반응에서 효소는 정촉매와 마찬가지로 반응의 활성화 에너지의 크기를 감소시킨다. 효소가 활성화 에너지를 감소시키므로 반응 속도는 효소를 사용할 때가 효소를 사용하지 않을 때보다 빠르다.
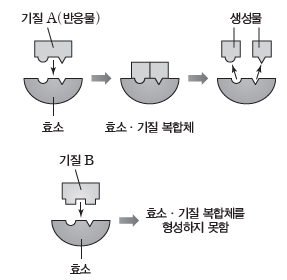
② 효소의 기질 특이성:효소에는 특정 기질과 반응할 수 있는 활성 부위가 존재한다. 따라서 효소는 특정 기질과 반응하며, 다른 기질과는 반응하지 않는 기질 특이성이 있다.
③ 효소의 작용과 온도 및 pH:효소는 주로 단백질로 이루어져 있기 때문에 온도와 pH의 영향을 받는다. 효소는 백금과 같은 표면 촉매와는 달리 최적 온도와 최적 pH가 있다. 일반적으로 온도가 높아질수록 반응 속도가 증가하지만 효소가 작용하는 반응의 경우 최적 온도 이상으로 온도가 높아지면 효소가 파괴되어 반응 속도가 현저하게 감소한다. 또한 pH에 따라서 도 효소의 활성 부위가 파괴될 수 있으므로 효소는 특정 pH에서 반응 속도가 최대가 된다.
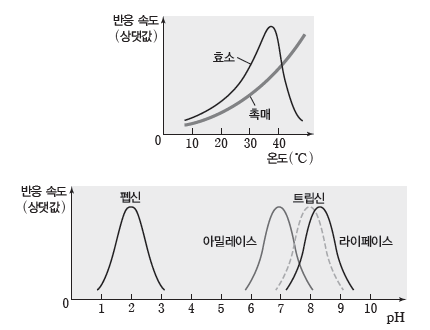
④ 효소의 중요성:효소는 생체 내에서 일어나는 반응의 촉매 역할을 하므로 시간이 오래 걸리는 반응들의 반응 속도를 빠르게 하여 반응이 쉽게 일어날 수 있게 하는 역할을 한다.
⑤ 효소의 이용:주로 식품에 이용하고 있으며 포도주, 치즈, 된장, 청국장, 식혜, 김치 등이 효소를 이용한 발효 식품의 예이다.
⑵ 현대 산업과 촉매
촉매를 사용하면 활성화 에너지가 낮아지므로 낮은 온도에서 반응이 빠르게 일어날 수 있어서 산업에서 제조 비용의 감소, 시간의 단축, 생산량 증가의 측면에서 매우 유용하다.
① 효소의 산업적 이용:효소를 산업에 적용하여 효율적으로 이용할 수 있다.

② 표면 촉매
- 백금(Pt), 팔라듐(Pd), 니켈(Ni)과 같은 다양한 금속이 포함된 고체 상태의 촉매로 암모니아의 합성, 탄소 사이의 2중 결합의 수소화 반응 등에 널리 사용되고 있다.
- 표면 촉매의 작용은 기체 또는 액체 상태의 반응물이 고체 상태의 촉매 표면에 흡착되어 일어난다.
예) 에텐(C2H4)의 수소화 반응에서 표면 촉매의 작용
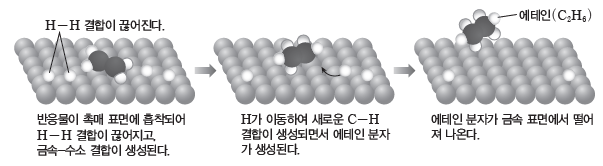
- 표면 촉매는 촉매로서의 활성이 높아서 널리 사용되지만, 불안정하고 부수적인 반응물에 대한 예측이 어려워서 폐기물의 문제가 나타나기도 한다.
③ 유기 촉매
- 반응을 조절하기 어려운 표면 촉매의 단점을 보완하고자 유기물 형태로 유기 촉매를 만들어 사용하고 있다.
- 유기 촉매는 반응의 선택성이 높고, 쉽게 분해될 수 있다.
예) 의약품의 합성 과정에서 유기 촉매로 사용할 수 있는 프롤린(C5H9NO2)
④ 광촉매
- 빛에너지를 받을 때 촉매 작용을 일으키는 물질을 광촉매라고 한다.
- 이산화 타이타늄(TiO2)이 가장 널리 사용되며, TiO2은 빛에너지를 받으면 물을 수소와 산소로 분해하거나 유기물을 분해하는 특징을 나타낸다.
예) TiO2은 수소 연료 전지에 수소를 공급하는 장치나 공기 청정기, 타일, 벽지 등의 세균 번식을 막는 데 이용된다.
참고자료: EBS 수능 특강 화학2