화학 반응 속도
⑴ 빠른 반응과 느린 반응:우리 주위에서 일어나는 다양한 화학 반응은 빠르게 일어나는 반응과 느리게 일어나는 반응으로 구분할 수 있다.
① 빠른 반응의 예:중화 반응, 연소 반응, 앙금 생성 반응 등
② 느린 반응의 예:석회 동굴의 생성 반응, 철의 부식 반응 등
⑵ 화학 반응의 빠르기 측정:화학 반응에 따라 여러 가지 방법으로 측정할 수 있다.
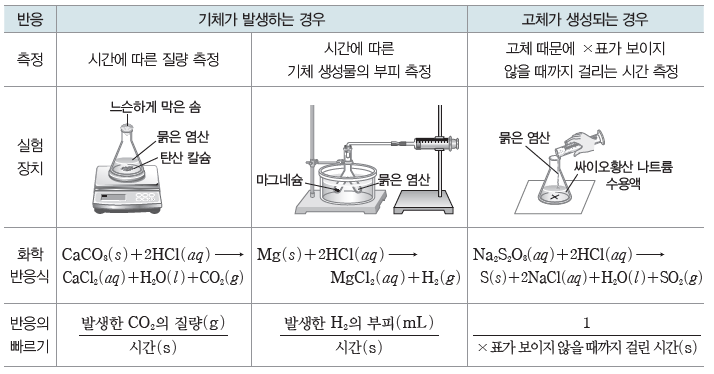
⑶ 반응 속도
화학 반응이 일어나는 빠르기이며, 반응 시간 동안의 반응물 또는 생성물의 농도 변화량으로나타낼 수 있다.

① 반응 속도의 표현:화학 반응이 일어날 때 시간 변화(Δt)에 따른 반응물의 농도 변화 또는생성물의 농도 변화로 반응 속도를 나타낸다. 화학 반응식에서 반응물이나 생성물의 농도 변화를 화학 반응식의 계수로 나누어서 나타낸다. 반응물의 농도는 반응 과정에서 감소하므로 반응 속도를 표현할 때에는 (-)를 붙인다.
예) H2(g)+I2(g) → 2HI(g)의 반응 속도 표현
- 반응 계수비가 H2 : I2 : HI=1 : 1 : 2이므로 H2의 농도가 감소하는 속도나 I2의 농도가 감소하는 속도는 HI의 농도가 증가하는 속도의 1/2과 같다.
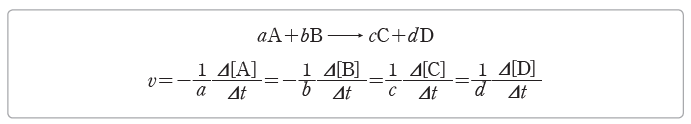
- 반응물과 생성물의 농도 변화에 따른 반응 속도 사이에는 다음과 같은 관계가 성립한다.
– Δ[H2]/Δt=- Δ[I2]/Δt=1/2 Δ[HI]/Δt
② 평균 반응 속도:반응물이나 생성물의 농도 변화량을 반응이 일어난 시간으로 나누어 나타내는 반응 속도이며, 시간·농도 그래프에서 두 점을 지나는 직선의 기울기(절댓값)에 해당한다.
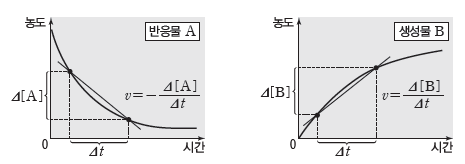
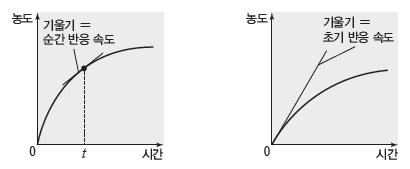
③ 순간 반응 속도:특정 시간에서의 반응 속도를 나타내며, 시간·농도 그래프에서 특정 시간(t)에서의 접선의 기울기(절댓값)에 해당한다.
④ 초기 반응 속도:시간·농도 그래프에서 t=0일 때의 순간 반응 속도이다.
반응 속도식
⑴ 반응 속도식(반응 속도 법칙):반응 속도(v)는 반응물의 농도에 따라 달라지며, 물질 A와B가 반응하여 물질 C와 D가 생성되는 반응에서 반응 속도식은 다음과 같이 나타낼 수 있다.
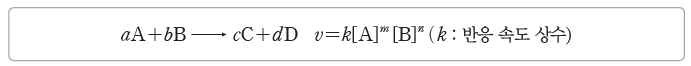
① 반응 차수
- m과 n은 반응 차수를 나타낸다.
- m, n은 실험을 통해 구하며, 반응식의 계수인 a, b와 관계가 없다.
- A에 대한 m차 반응, B에 대한 n차 반응이고, 전체 반응 차수는 (m+n)이다.
예) 화학 반응식과 반응 속도식

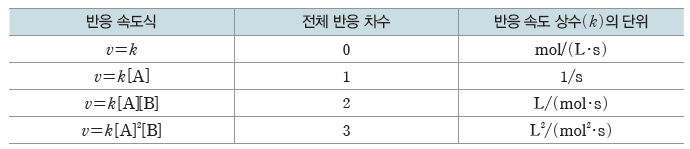
② 반응 속도 상수(k):k는 반응에 따라 다른 값을 가지며, 농도에 따라서는 달라지지 않는 상수로, 온도와 활성화 에너지에 따라서는 그 값이 달라진다. k의 단위는 전체 반응 차수에 따라 다르다.
예) v=k[A]2[B]의 반응 속도식에서 전체 반응 차수는 3이고, 반응 속도 상수(k)는k=v/[A]2[B]이므로 반응 시간의 단위가 s일 때, k의 단위는mol/(L·s)/(mol/L)2×(mol/L)=L2/(mol2·s)이다.
③ 반응 속도식에서 전체 반응 차수와 반응 속도 상수(k)의 단위는 표와 같이 나타낼 수 있다.
⑵ 반응 차수와 반응 속도 상수의 결정
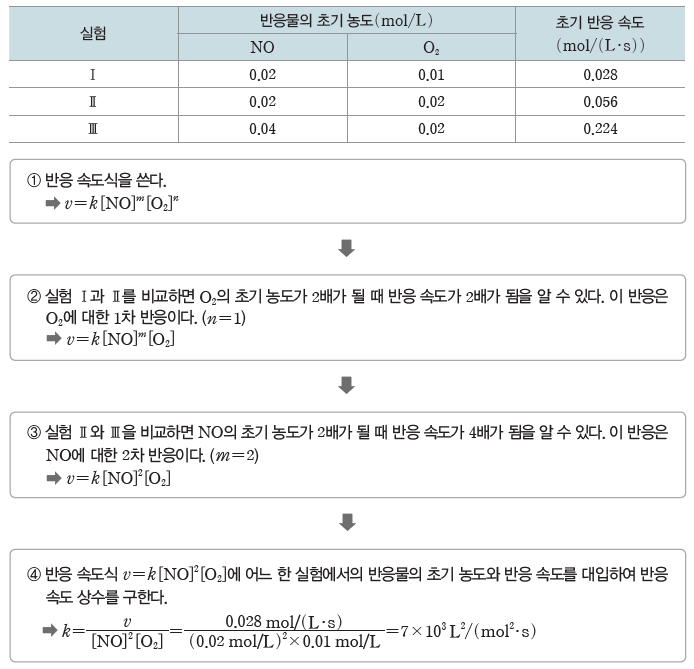
v=k[A]m[B]n 에서 반응 차수 m과 n은 실험을 통해 구한다. 한 물질의 초기 농도가 같은 상태에서 다른 물질의 초기 농도를 변화시켜 가면서 초기 반응 속도를 측정한 다음, 반응물의 초기 농도비와 초기 반응 속도비를 비교하면 구할 수 있다.
예) 2NO(g)+O2(g) → 2NO2(g)의 반응에서 반응물인 NO와 O2의 초기 농도를 달리하면서 초기 반응 속도를 측정한다.
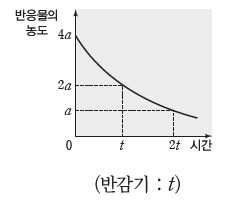
⑶ 1차 반응과 반감기
① 1차 반응의 특징:1차 반응에서 반응 속도는 반응물의 농도에 비례한다. 반응물의 농도에 따른 반응 속도 그래프에서 기울기는 반응 속도 상수(k)에 해당한다.
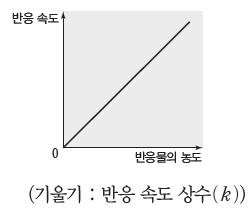
예) •오산화 이질소(N2O5)의 분해 반응
2N2O5(g) → 4NO2(g)+O2(g) v=k[N2O5]
- 과산화 수소(H2O2)의 분해 반응
2H2O2(aq) → 2H2O(l)+O2(g) v=k[H2O2]
② 반감기:반응물의 농도가 반으로 줄어들 때까지 걸리는 시간이며, 반감기는 반응 차수에 따라 다른 특성을 나타낸다.
- 1차 반응과 반감기:1차 반응에서 반감기는 반응물의 농도에 관계없이 일정하다.
활성화 에너지
⑴ 화학 반응과 충돌 방향
화학 반응이 일어나려면 반응하는 물질의 입자들이 충돌해야 하며, 충돌하는 순간에 입자들의 방향이 화학 반응을 일으키기에 적합해야 한다.
예) NO2(g)+CO(g) → NO(g)+CO2(g)의 반응에서 입자들의 충돌 방향과 화학 반응
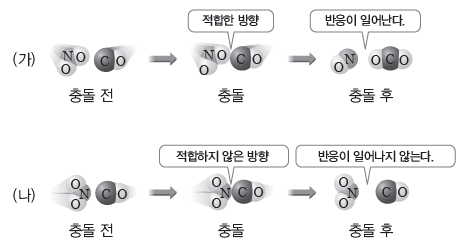
NO2(g)와 CO(g)가 반응하여 NO(g)와 CO2(g)를 생성하기 위해서는 (가)와 같이 NO2(g)의 O 원자와 CO(g)의 C 원자가 충돌해야 한다. (나)와 같이 적합하지 않은 방향으로 충돌하면 반응은 일어나지 않는다.
⑵ 활성화 에너지(Ea)
① 활성화 에너지:화학 반응을 일으키는 데 필요한 최소한의 에너지이다. 활성화 에너지는 반응물이 생성물로 되기 위해 넘어야 하는 에너지 장벽이라고 할 수 있다.
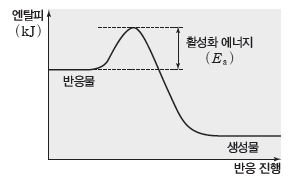
② 활성화 에너지(Ea)와 반응 엔탈피(ΔH):반응 엔탈피(ΔH)는 생성물의 엔탈피 합에서 반응물의 엔탈피 합을 뺀 값에 해당하므로 활성화 에너지와는 관계가 없다.
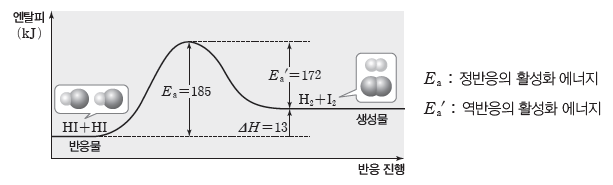
③ 활성화 에너지와 반응 속도:온도와 반응물의 농도가 일정할 때, 반응의 활성화 에너지가 작을수록 반응 속도가 빠르고, 활성화 에너지가 클수록 반응 속도가 느리다.
⑶ 유효 충돌과 비유효 충돌
① 유효 충돌:활성화 에너지 이상의 에너지를 가진 입자들이 화학 반응이 일어나기에 적합한 방향으로 충돌하여 화학반응이 일어나는 충돌이다.
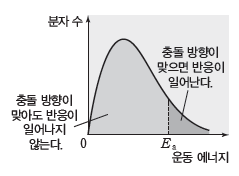
② 비유효 충돌:충돌 방향이 반응이 일어나는 데 적합하지 않거나 입자의 에너지가 활성화 에너지보다 작을 때 충돌해도 화학 반응이 일어나지 않는 충돌이다.
참고자료: EBS 수능 특강 화학2