화학 평형
⑴ 가역 반응과 비가역 반응
① 가역 반응:농도, 압력, 온도 등의 반응 조건에 따라 정반응과 역반응이 모두 일어날 수 있는 반응으로, 화학 반응식에서 ⇆로 나타낸다. 정반응은 화학 반응식에서 오른쪽으로 진행되는 반응이고 역반응은 왼쪽으로 진행되는 반응이다.
예) 2NO2(g) ⇆ N2O4(g)
N2(g)+3H2(g) ⇆ 2NH3(g)
② 비가역 반응:한쪽 방향으로만 진행되는 반응으로, 정반응에 비해 역반응이 무시할 수 있을 만큼 거의 일어나지 않는다.
예) 연소 반응:C3H8(g)+5O2(g) → 3CO2(g)+4H2O(l)
앙금 생성 반응:Na2CO3(aq)+CaCl2(aq) → CaCO3(s)+2NaCl(aq)
⑵ 화학 평형 상태
가역 반응에서 반응물과 생성물의 농도가 변하지 않아서 겉으로 보기에 반응이 정지된 것처럼 보이는 상태를 화학 평형 상태라고 한다. 그러나 반응이 정지된 것이 아니라 실제로 정반응과 역반응이 같은 속도로 일어나고 있는 동적 평형 상태이다.
예) NO2와 N2O4의 화학 평형 (2NO2(g) ⇆ N2O4(g))
❶ 반응 용기에 NO2만 넣었을 때
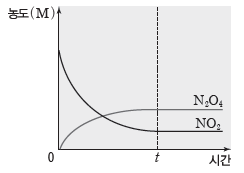
반응 용기에 NO2를 넣으면 정반응이 진행되어 시간이 지남에 따라 NO2의 농도는 감소하고 N2O4의 농도는 증가한다. N2O4가 생성되면 역반응도 진행된다. 시간 t 이후에는 NO2와 N2O4의 농도는 각각 일정해진다. NO2가 소모되는 반응과 NO2가 생성되는 반응이 같은 속도로 일어나 겉으로 보기에 반응이 정지된 것처럼 보인다. 시간 t 이후는 화학 평형 상태이다.
❷ 반응 용기에 N2O4만 넣었을 때
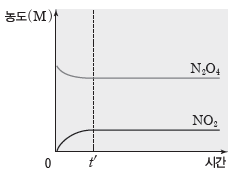
반응 용기에 N2O4를 넣으면 역반응이 진행되어 시간이 지남에 따라 N2O4의 농도는 감소하고 NO2의 농도는 증가한다. 시간 t’ 이후에는 NO2와 N2O4의 농도는 각각 일정해진다. 시간 t’ 이후는 화학 평형상태이다.
⑶ 화학 평형 상태의 성질
① 화학 평형 상태에서 외부 조건(온도, 압력 등)이 변하지 않으면 반응물과 생성물의 농도는 각각 일정하게 유지된다.
② 용기에 반응물이나 생성물만 넣어도 반응이 진행되어 화학 평형 상태에 도달한다.
③ 화학 평형 상태에서 반응물과 생성물의 농도비는 화학 반응식의 계수비와 무관하다.
예) 강철 용기에서 일어나는 암모니아 합성 반응(N2(g)+3H2(g) ⇆ 2NH3(g))에서 반응 농도비는 화학 반응식의 계수비와 같은 1:3:2이지만, 화학 평형 상태의 농도비는 계수비와 같지 않다.
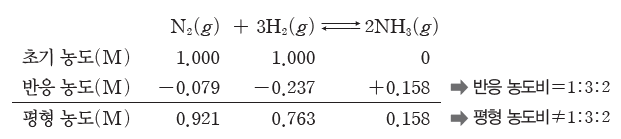
평형 상수
⑴ 화학 평형 법칙
일정한 온도에서 어떤 가역 반응이 화학 평형 상태에 있을 때, 반응물의 농도 곱에 대한 생성물의 농도 곱의 비는 항상 일정하다. 화학 평형 상태에서 이 값을 평형 상수(K)라고 한다.
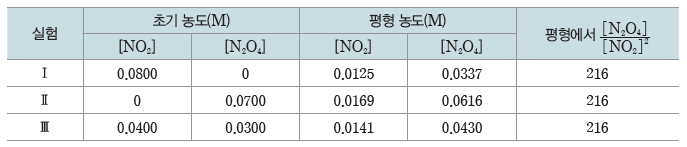
예) 일정한 온도에서 NO2와 N2O4를 서로 다른 초기 농도로 넣고 반응시켜 평형 상태에 도달하였을 때 [N2O4]/[NO2]의 값은 항상 일정하다.
2NO2(g) ⇆ N2O4(g)
⑵ 평형 상수(K)
반응물 A와 B가 반응하여 생성물 C와 D가 생성되는 반응에서 평형 상수(K)는 각 물질의 평형 농도(M)로부터 다음과 같이 구할 수 있으며, 평형 상수는 단위가 없다.

① 평형 상수는 온도에 의해서만 달라지며 농도나 기체의 압력에 의해서는 달라지지 않는다.
② 정반응의 평형 상수가 K일 때 역반응의 평형 상수(K’)는1/K이다.
예) 2A(g)+B(g) ⇆ 2C(g) K= [C]2/[A]2[B]
예) 2C(g) ⇆ 2A(g)+B(g) K’= [A]2[B]/[C]2=1/K
③ 고체 물질이나 용매는 평형 상수식에 나타내지 않는다.
예) CaCO3(s) ⇆ CaO(s)+CO2(g) K=[CO2]
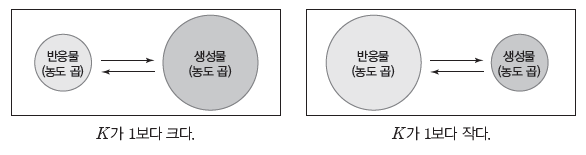
⑶ 평형 상수(K)의 의미
① K가 1보다 큰 경우:화학 평형 상태에서 반응물의 농도 곱에 비해 생성물의 농도 곱이 크다.
② K가 1보다 작은 경우:화학 평형 상태에서 생성물의 농도 곱에 비해 반응물의 농도 곱이 크다.
⑷ 평형 상수의 계산
① 화학 반응식을 완결하고 평형 상수식을 쓴다.
② 화학 반응의 양적 관계를 이용하여 화학 평형 상태에서 각 물질의 몰 농도를 구한다.
③ 평형 상수식에 각 물질의 평형 농도(M)를 대입하여 평형 상수를 구한다.
예) 일정한 온도에서 부피가 1.0 L인 강철 용기에 N2 2.5 mol, H2 6.5 mol을 넣고 반응시켰을 때 평형 상태에서 NH3 3.0 mol이 생성된 경우의 평형 상수 계산하기

⑸ 반응 지수(Q)를 통한 화학 반응의 진행 방향 예측
① 반응 지수(Q):평형 상수식에 반응물과 생성물의 현재 농도(M)를 대입하여 구한 값이다.

② 화학 반응의 진행 방향 예측:같은 온도에서 반응 지수(Q)를 평형 상수(K)와 비교하여 반응의 진행 방향을 예측할 수 있다. Q와 K가 같으면 화학 평형 상태이고, 평형에 도달하지 않은 반응은 Q가 K와 같아질 때까지 정반응 또는 역반응 쪽으로 우세하게 반응이 진행된다.

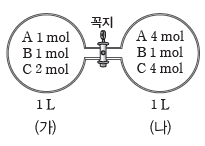
예) 부피가 1 L인 용기 내부에 혼합 기체가 각각 평형을 이루고 있는 상태에서 꼭지를 열었을 때 반응의 진행 방향 예측(단, 온도는 일정하고 연결관의 부피는 무시함)

화학 평형의 이동
⑴ 평형 이동 법칙(르샤틀리에 원리)
화학 평형 상태에 있는 화학 반응에서 농도, 온도, 압력 등의 반응 조건을 변화시키면, 그 변화를 상쇄하려는 방향으로 반응이 우세하게 진행되어 새로운 평형에 도달하게 된다.
⑵ 평형 이동에 영향을 미치는 요인
① 농도 변화에 의한 평형 이동:평형 상태에 있는 화학 반응에서 반응물이나 생성물의 농도를 변화시키면 농도 변화를 상쇄하려는 방향으로 반응이 진행되어 새로운 평형에 도달한다. 농도 변화에 의한 평형 이동이 일어나도 온도가 변하지 않으면 평형 상수(K)는 변하지 않는다.

② 압력 변화에 의한 평형 이동:화학 평형 상태에 있는 화학 반응에서 압력을 높이면 압력을 낮추는 방향으로 평형이 이동하고, 압력을 낮추면 압력을 높이는 방향으로 평형이 이동한다.
- 고체와 액체의 농도는 압력의 영향을 받지 않고, 기체의 경우에는 압력의 영향을 받는다.
예) CaCO3(s) ⇆ CaO(s)+CO2(g)의 반응에서 압력 변화와 평형 이동
CaCO3과 CaO이 고체이므로 압력 변화에 의한 평형의 이동은 CO2의 압력에 의해 좌우된다.
- 압력 변화에 의한 평형 이동이 이루어지더라도 온도가 변하지 않으면 평형 상수(K)에는 변화가 없다.
예) N2O4(g) ⇆ 2NO2(g)의 반응에서 압력 변화와 평형 이동
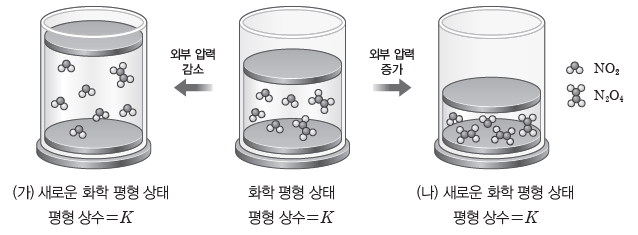
압력을 감소시키면 압력이 증가하는 방향으로 평형이 이동해야 하므로 전체 기체 분자 수가 증가하는 정반응 쪽으로 반응이 진행되어 새로운 평형인 (가)에 도달한다. N2O4가 NO2로 변화하며 전체 기체 분자 수가 증가한다. 압력을 증가시키면 압력이 감소하는 방향으로 평형이 이동해야 하므로 전체 기체 분자 수가 감소하는 역반응 쪽으로 반응이 진행되어 새로운 평형인 (나)에 도달한다. NO2가 N2O4로 변화하며 전체 기체 분자 수가 감소한다.
화학 평형 상태에서 (가)와 (나)의 새로운 화학 평형 상태로 이동하더라도 온도가 변하지 않으면 평형 상수는 K로 일정하다.
- 부피가 일정한 용기에서 비활성 기체 등 반응에 영향을 주지 않는 기체를 첨가한 경우에는반응물이나 생성물의 몰 농도(M)가 변하지 않으므로 평형이 이동하지 않는다.
③ 온도 변화에 의한 평형 이동:화학 평형 상태에 있는 화학 반응에서 온도를 높이면 열을 흡수하는 흡열 반응 쪽으로 평형이 이동하고, 온도를 낮추면 열을 방출하는 발열 반응 쪽으로 평형이 이동한다.
- 평형 상태에서 온도가 일정할 때 농도나 압력이 변해 새로운 평형 상태에 도달해도 평형 상수는 일정하지만, 온도가 변하면 평형 상수가 달라진다. 정반응이 흡열 반응일 때 온도를 높이면 평형 상수는 증가하고, 온도를 낮추면 평형 상수는 감소한다. 정반응이 발열 반응일 때 온도를 높이면 평형 상수는 감소하고, 온도를 낮추면 평형 상수는 증가한다.
예) N2(g)+3H2(g) ⇆ 2NH3(g) 반응(ΔH=-92.2 kJ)의 온도에 따른 평형 상수
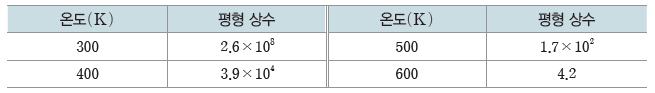
이 반응은 발열 반응이므로 온도를 높이면 평형 상수가 감소한다.
④ 촉매와 평형 이동:촉매는 반응 속도에는 영향을 미치지만 평형을 이동시키지는 않는다. 따라서 촉매는 평형 상수나 생성물의 양에는 영향을 주지 않는다.
평형 이동의 응용
⑴ 수득률
화학 반응에서 이론상 최대로 얻을 수 있는 생성물의 양에 대한 실제로 얻어진 생성물의 양의 비율이다.

① 압력에 의한 영향:기체 분자 수가 감소하는 반응의 경우에는 압력을 높이면 정반응 쪽으로 평형이 이동하므로 수득률은 증가하고, 압력을 낮추면 역반응 쪽으로 평형이 이동하므로 수득률은 감소한다.
② 온도에 의한 영향:정반응이 흡열 반응인 경우에는 온도를 높이면 정반응 쪽으로 평형이 이동하므로 수득률은 증가하고, 온도를 낮추면 역반응 쪽으로 평형이 이동하므로 수득률은 감소한다.
⑵ 실생활에서의 화학 평형 이동
① 고압 산소 치료실은 산소의 압력이 높기 때문에 폐를 통해 혈액 속으로 산소가 많이 녹아 들어가 상처 치료가 빨라진다.
② 설탕이 물에 용해되는 반응은 흡열 반응이므로 온도를 높이면 설탕이 물에 잘 용해된다.
③ 이산화 탄소가 물에 용해되는 반응은 발열 반응이므로 온도를 낮추면 이산화 탄소가 물에 잘용해된다. 따라서 밀폐되지 않은 탄산음료를 상온에 보관하면 용해되어 있는 이산화 탄소의 양이 감소하므로 톡 쏘는 느낌이 적어진다.
상평형
⑴ 온도와 압력에 의한 상태 변화
① 온도에 의한 상태 변화:얼음에 열을 가하여 온도를 높이면 물이 되고, 온도를 더 높이면 수증기가 된다.
② 압력에 의한 상태 변화:얼음에 압력을 가하면 물이 된다. 고압의 가스통에 들어 있는 액체 뷰테인은 밸브를 열면 기체로 빠져나온다.
⑵ 상평형 그림
온도와 압력에 따른 물질의 상태를 나타낸 그림이다. 승화 곡선, 증기 압력 곡선(기화 곡선), 융해 곡선으로 이루어져 있고, 곡선 상의 모든 점에서 2가지 상태가 공존하여 평형을 이룬다(단, 삼중점에서는 3가지 상태가 공존하여 평형을 이룬다).
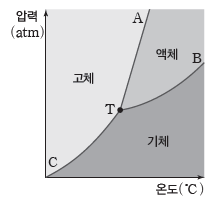
① 융해 곡선(AT):고체와 액체가 상평형을 이루는 온도와 압력을 나타낸 곡선이다.
② 증기 압력 곡선(기화 곡선, BT):액체와 기체가 상평형을 이루는 온도와 압력을 나타낸 곡선이다.
③ 승화 곡선(CT):고체와 기체가 상평형을 이루는 온도와 압력을 나타낸 곡선이다.
④ 삼중점(T):기체, 액체, 고체의 3가지 상태가 공존하여 평형을 이루는 온도와 압력이다.
⑤ 어는점(녹는점):고체와 액체가 상평형을 이루는 온도이다.
⑥ 끓는점:액체와 기체가 상평형을 이루는 온도이다.
⑶ 물의 상평형 그림
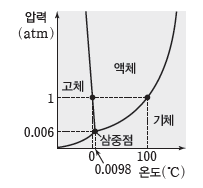
① 물은 융해 곡선의 기울기가 (-)값을 가지므로 외부 압력이 커지면 어는점이 낮아진다.
② 물은 삼중점의 압력이 0.006 atm이므로 1 atm에서는 온도를 높일 때 고체에서 액체를 거쳐 기체로 상태가 변하지만, 0.006 atm보다 낮은 압력에서는 온도를 높일 때 고체 상태에서 액체 상태를 거치지 않고 기체 상태로 승화가 일어난다.
⑷ 이산화 탄소의 상평형 그림
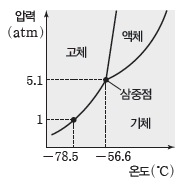
① 이산화 탄소는 융해 곡선의 기울기가 (+)값을 가지므로 외부 압력이 커지면 어는점이 높아진다.
② 이산화 탄소는 삼중점의 압력이 5.1 atm으로 1 atm보다 높으므로 1 atm에서 온도를 높이면 고체 이산화 탄소(드라이아이스)는 승화한다.
③ 액체 이산화 탄소를 만들기 위해서는 5.1 atm 이상의 압력이 필요하다.
⑸ 상평형 그림과 물질의 상태 변화
① 물의 상평형 그림에서 증기 압력 곡선을 보면 압력이 높아질수록 끓는점이 높아지는 것을 알수 있다. 압력솥에서 밥을 지을 경우 1 atm보다 높은 압력으로 물의 끓는점이 100℃보다 높아지므로 높은 온도에서 밥이 빨리 된다. 반면 높은 산에서 밥을 지을 경우 1 atm보다 낮은 압력으로 물의 끓는점이 100℃보다 낮아지므로 낮은 온도에서 밥이 설익는다. 이때 냄비에 돌을 올려놓으면 압력을 높일 수 있어 밥이 설익는 것을 막을 수 있다.
② 물의 상평형 그림에서 융해 곡선을 보면 압력이 높아질수록 녹는점이 낮아지는 것을 알 수있다. 추가 달린 실을 얼음에 올리면 압력에 의해 얼음이 녹아 실이 얼음 속으로 들어간다.
③ 동결 건조 식품은 재료의 온도를 급속히 낮추어 얼린 후 삼중점에서의 압력보다 낮은 압력에서 얼음을 수증기로 승화시켜 건조한 식품이다. 저온에서 건조하므로 맛과 향, 영양소 파괴가 적다. 이는 우주 식품이나 라면 건더기 스프, 인스턴트 커피 등을 만드는 데 이용한다.
참고자료: EBS 수능 특강 화학2