용액의 농도
⑴ 농도
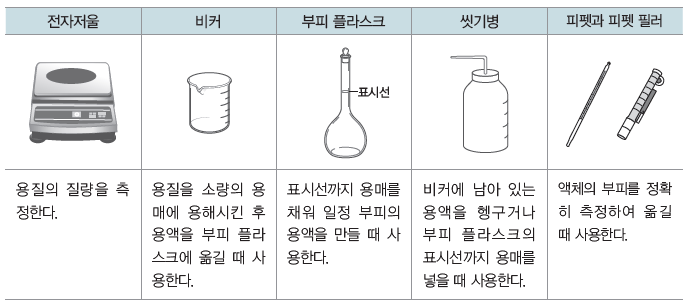
용매와 용질이 섞여 있는 비율을 용액의 농도라고 하며, 농도의 종류에는 퍼센트 농도, ppm농도, 몰 농도, 몰랄 농도 등이 있다.
⑵ 퍼센트 농도
용액 100 g 속에 녹아 있는 용질의 질량(g)을 나타낸 농도로, 단위는 %를 사용한다.

① 용액과 용질의 질량으로 나타내므로 온도나 압력의 영향을 받지 않는다.
② 용액의 퍼센트 농도를 이용하면 용액에 녹아 있는 용질의 질량을 구할 수 있다.

⑶ ppm 농도
ppm은 ‘parts per million’의 약자로 백만분의 1을 나타내는 단위이다.

① 주로 공기나 물속에 극소량 들어 있는 물질의 농도를 나타낼 때 사용한다.
② 용액의 농도로 쓰일 때에는 용액 106 g 속에 녹아 있는 용질의 질량(g)을 나타낸다.
⑷ 몰 농도
용액 1 L 속에 녹아 있는 용질의 양(mol)을 나타낸 농도로, 단위는 mol/L 또는 M를 사용한다.

① 용액의 부피를 기준으로 하기 때문에 화학 실험에서 사용하기에 편리하다.
② 온도에 따라 용액의 부피가 변하므로 몰 농도는 온도에 따라 달라진다.
③ 용액의 몰 농도와 부피를 알면 용액에 녹아 있는 용질의 양(mol)을 구할 수 있다.

④ 특정한 몰 농도의 용액을 만들 때 필요한 기구
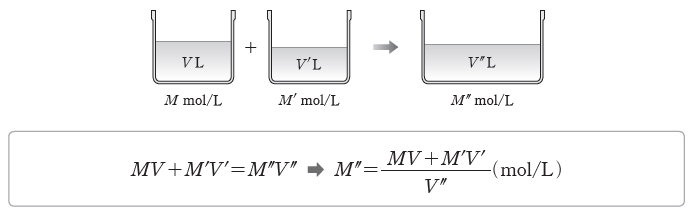
⑤ 용액 희석하기:어떤 용액에 용매를 가하여 용액을 희석했을 때, 용액의 부피와 농도는 달라지지만 그 속에 녹아 있는 용질의 양(mol)은 변하지 않는다. 용액의 농도가 M(mol/L)인 용액 V(L)에 용매를 가하여 농도가 M'(mol/L)인 용액 V'(L)가 되었다면 두 용액에서 용질의 양(mol)이 같으므로 다음과 같은 관계가 성립한다.

⑥ 혼합 용액의 몰 농도:같은 종류의 용질이 용해되어 있고 농도가 서로 다른 두 용액을 혼합하면, 용질의 전체 양(mol)은 변하지 않으므로 다음과 같은 관계가 성립한다.
⑸ 몰랄 농도
용매 1 kg에 녹인 용질의 양(mol)을 나타낸 농도로, 단위는 mol/kg 또는 m를 사용한다.
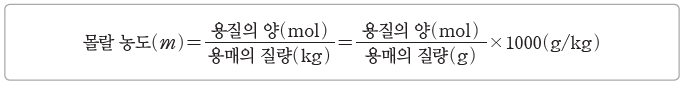
① 용매의 질량과 용질의 양(mol)은 온도의 영향을 받지 않으므로 몰랄 농도는 온도의 영향을 받지 않는다.
② 용액의 몰랄 농도와 용매의 질량을 알면 용액에 녹아 있는 용질의 양(mol)을 구할 수 있다.

⑹ 몰 분율
균일한 혼합물에서 각 성분의 양(mol)을 혼합물의 전체 양(mol)으로 나눈 값이다.
① 몰 분율은 용매와 용질 구분없이 입자 수를 기준으로 하며, 각 성분의 몰 분율을 모두 더하면 1이 된다.

② 용질의 몰 분율이 클수록 일정량의 용매에 녹인 용질의 양(mol)이 크므로 몰 분율도 농도의 의미를 포함한다.
③ 물질의 양(mol)은 온도의 영향을 받지 않으므로 몰 분율은 온도의 영항을 받지 않는다.
⑺ 농도의 변환
① 퍼센트 농도(%)를 몰 농도(M)로 변환:용액의 부피를 1 L라고 가정하고, 용액의 밀도, 퍼센트 농도, 용질의 화학식량을 이용하여 몰 농도를 구한다.

② 퍼센트 농도(%)를 몰랄 농도(m)로 변환:용액의 질량을 100 g이라고 가정하고, 용액의 퍼센트 농도와 용질의 화학식량을 이용하여 몰랄 농도를 구한다.

③ 몰 농도(M)를 몰랄 농도(m)로 변환:용액의 부피를 1 L라고 가정하고, 용액의 밀도, 몰농도, 용질의 화학식량을 이용하여 몰랄 농도를 구한다.

용액의 증기 압력 내림
⑴ 증기 압력
일정한 온도에서 진공 상태의 밀폐 용기 속에 액체를 넣고 충분한 시간이 지나면 증발 속도와 응축 속도가 같아지는데, 이때 용기 속 기체가 나타내는 압력을 그 액체의 증기 압력이라고 한다.
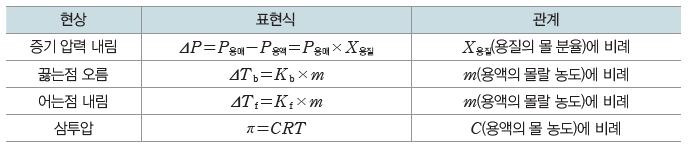
⑵ 증기 압력 내림(ΔP)
비휘발성 용질이 녹아 있는 묽은 용액에서 용액의 증기 압력은 순수한 용매의 증기 압력보다작아진다.
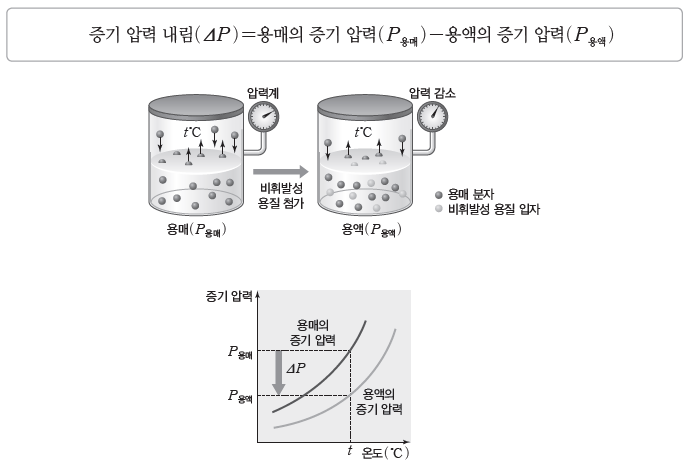
① 용액의 농도가 진할수록 증기 압력 내림이 커진다.
② 온도가 일정할 때 증기 압력 내림은 용질의 종류에는 영향을 받지 않고, 용매의 종류와 용질의 몰 분율에만 영향을 받는다.
⑶ 묽은 용액의 증기 압력 내림
① 라울 법칙:비휘발성, 비전해질인 용질이 녹아 있는 묽은 용액의 증기 압력(P용액)은 용매의 몰 분율(X용매)에 비례한다.
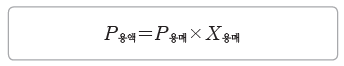
② 묽은 용액의 증기 압력 내림(ΔP)은 용질의 몰 분율(X용질)에 비례한다.
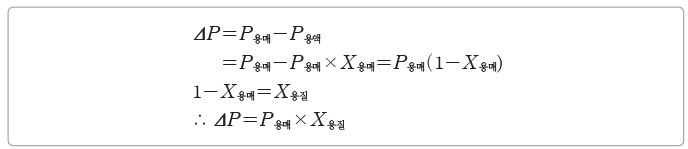
③ 용액의 농도가 진해질수록 용질의 몰 분율이 커지므로 증기 압력 내림도 커진다.
용액의 끓는점 오름과 어는점 내림
⑴ 용액의 끓는점과 어는점
① 액체는 증기 압력이 외부 압력과 같을 때 끓게 된다. 같은 온도에서 비휘발성인 용질이 녹아있는 용액의 증기 압력은 용질의 방해에 의해 용매의 증기 압력보다 작으므로 용액이 끓기 위해서는 용매의 끓는점보다 더 높은 온도가 필요하다. 그러므로 용액의 끓는점은 용매의 끓는점보다 높다.
② 비휘발성인 용질이 녹아 있는 용액이 어는 과정에서 용질의 방해가 있으므로 용액이 얼기 위해서는 용매의 어는점보다 더 낮은 온도가 필요하다. 그러므로 용액의 어는점은 용매보다 낮다.
③ 용액의 끓는점(Tb‘)과 용매의 끓는점(Tb)의 차를 끓는점 오름(ΔTb)이라고 하고, 용매의 어는점(Tf)과 용액의 어는점(Tf‘)의 차를 어는점 내림(ΔTf)이라고 한다.
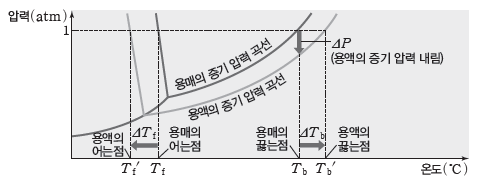
⑵ 끓는점 오름(ΔTb)과 어는점 내림(ΔTf)에 영향을 미치는 요인
묽은 용액의 끓는점 오름(ΔTb)과 어는점 내림(ΔTf)은 용매의 종류와 용액 속에 녹아 있는 용질의 입자 수(몰랄 농도)에만 영향을 받는다.
⑶ 몰랄 오름 상수와 몰랄 내림 상수
① 몰랄 오름 상수(Kb):용액의 농도가 1 m일 때의 끓는점 오름
② 몰랄 내림 상수(Kf):용액의 농도가 1 m일 때의 어는점 내림
③ 몰랄 오름 상수(Kb)와 몰랄 내림 상수(Kf)는 용질의 종류와는 관계없이 용매의 종류에 따라 달라진다.
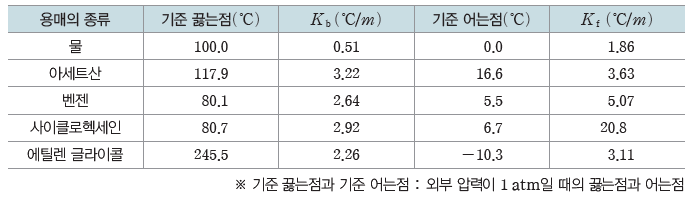
④ 비휘발성, 비전해질 용질이 녹아 있는 묽은 용액의 끓는점 오름(ΔTb)과 어는점 내림(ΔTf)은 용액의 몰랄 농도(m)에 비례한다.

⑤ 끓는점 오름ΔTb)과 어는점 내림(ΔTf)을 이용하여 묽은 용액에 녹아 있는 용질의 분자량을 구할 수 있다.

⑷ 일상생활에서의 끓는점 오름과 어는점 내림
① 끓는점 오름
- 1 atm에서 끓고 있는 김치찌개의 온도는 100℃보다 높다.
- 1 atm에서 물에 라면 스프를 넣으면 100℃보다 높은 온도에서 끓는다.
② 어는점 내림
- 바닷물은 강물보다 더 낮은 온도에서 언다.
- 눈이 많이 오면 도로에 염화 칼슘을 뿌려 준다.
삼투 현상과 삼투압
⑴ 삼투 현상
① 삼투:반투막을 사이에 두고 농도가 서로 다른 용액이 있을 때 용매 분자가 반투막을 통해이동하여 농도가 진한 용액은 농도가 점점 묽어지고 농도가 묽은 용액은 농도가 점점 진해지는데, 이러한 현상을 삼투라고 한다.
예) •소금물에 담가놓은 배추가 쭈글쭈글해진다.
- 짠 음식을 먹으면 갈증을 더 많이 느낀다.
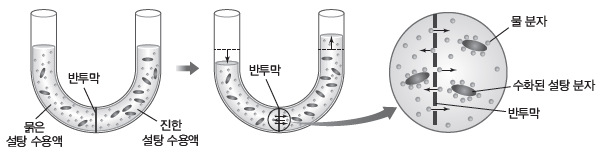
② 반투막:물과 같이 크기가 작은 용매 입자는 통과시키지만, 용매화되어 크기가 큰 용질 입자는 통과시키지 못하는 막을 반투막이라고 한다.
예) 셀로판지, 달걀의 속껍질, 세포막
⑵ 삼투압
① 삼투압:반투막을 사이에 두고 순수한 용매와 용액이 있을 때 용매 분자가 용액 쪽으로 더 많이 이동하는 삼투 현상을 막기 위해 용액 쪽에 가해 주어야 하는 최소한의 압력을 삼투압이라고 한다.
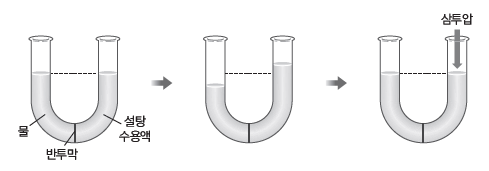
② 삼투압의 크기:용질의 종류와는 관계없이 일정량의 묽은 용액에 녹아 있는 용질의 입자 수에 비례한다.
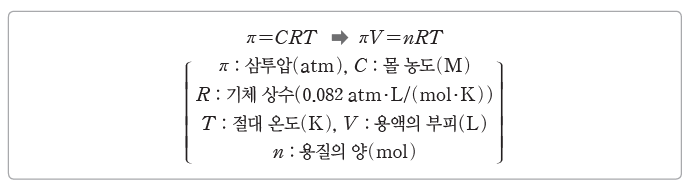
⑶ 반트호프 법칙
① 비휘발성, 비전해질 용질이 녹아 있는 묽은 용액의 삼투압은 용액의 몰 농도와 절대 온도에 비례한다.
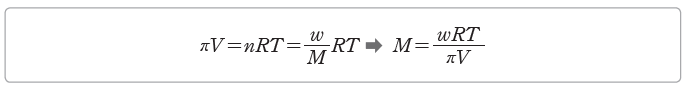
② 반트호프 법칙을 이용한 비휘발성, 비전해질 용질의 분자량 측정:용질의 질량이 w g이고 분자량이 M이면 용질의 양(mol) n=w/M이므로 반트호프 법칙을 다음과 같이 나타낼 수 있다.
묽은 용액의 총괄성
비휘발성, 비전해질 용질이 녹아 있는 묽은 용액에서 증기 압력 내림, 끓는점 오름, 어는점 내림, 삼투압은 용질의 종류와 관계없이 용질의 입자 수에만 비례하는데, 이러한 성질을 묽은 용액의 총괄성이라고 한다. 묽은 용액 속에 존재하는 용질의 입자 수가 증가하면 증기 압력 내림, 끓는점 오름, 어는점 내림, 삼투압도 증가한다.
참고자료: EBS 수능특강 화학2