분자의 구조
(1) 전자쌍 반발 이론
① 분자 또는 이온에서 중심 원자 주위의 전자쌍들은 모두 음전하를 띠고 있어 서로 반발하여가능한 멀리 떨어져 있으려고 한다.
② 중심 원자 주위에 있는 전자쌍 수에 따라 전자쌍의 배열이 달라진다.
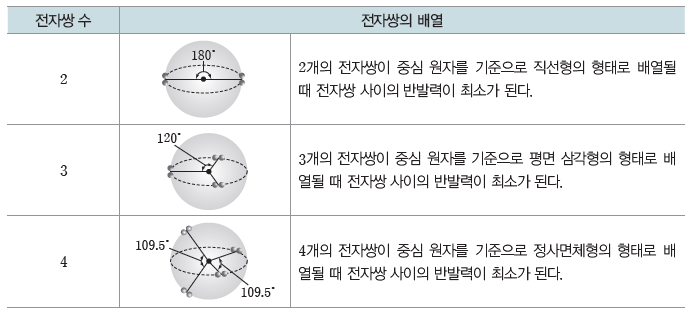
③ 전자쌍 사이의 반발력 크기:중심 원자의 공유 전자쌍은 2개의 원자가 공유하고 있으나, 비공유 전자쌍은 중심 원자에만 속해 있어 중심 원자 주위에서 공유 전자쌍보다 더 큰 공간을 차지한다. 따라서 비공유 전자쌍 사이의 반발력이 공유 전자쌍 사이의 반발력보다 크다.

(2) 결합각
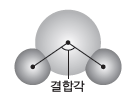
분자나 이온에서 중심 원자의 원자핵과 중심 원자와 결합한 두 원자의 원자핵을 선으로 연결하였을 때 생기는 내각을 결합각이라고 한다.
(3) 분자의 구조
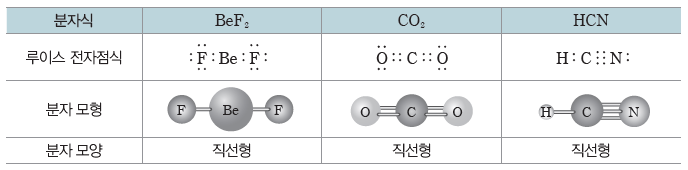
① 이원자 분자의 경우:2개의 원자가 결합하고 있으므로 두 원자핵이 동일한 직선 상에 존재한다.
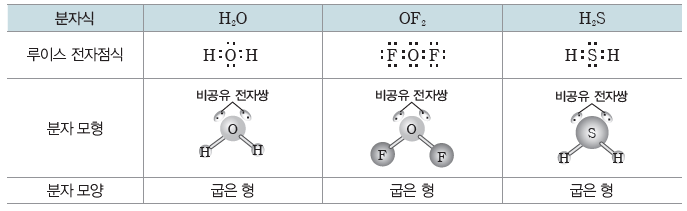
② 중심 원자가 공유 전자쌍만 가지는 경우:중심 원자에 결합된 원자의 수에 따라 분자의 모양이 달라진다.
- 중심 원자에 2개의 원자가 결합된 경우:직선형
- 중심 원자에 3개의 원자가 결합된 경우:평면 삼각형
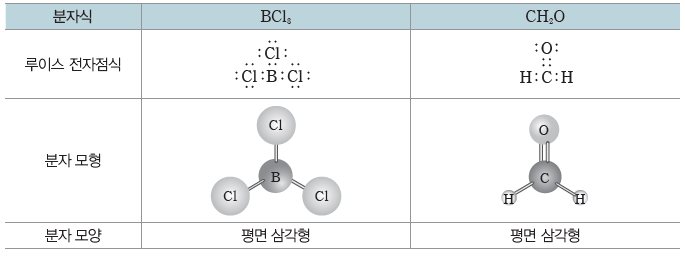
- 중심 원자에 4개의 원자가 결합된 경우:정사면체형 또는 사면체형
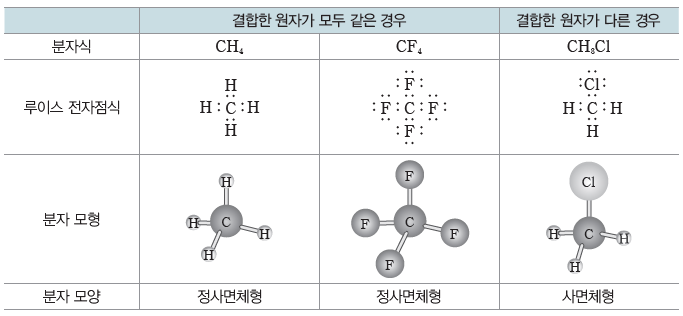
- CH4, CF4 등과 같이 중심 원자에 비공유 전자쌍이 없고 중심 원자와 결합한 4개의 원자가 모두 같은 경우 분자의 모양은 정사면체형이다.
- CH3Cl과 같이 중심 원자에 비공유 전자쌍이 없고 중심 원자와 결합한 4개의 원자들이 서로 다른 경우에는 결합한 원자의 크기와 전기 음성도가 달라 결합각이 달라져 분자의 모양은 사면체형이 된다.
③ 중심 원자가 비공유 전자쌍을 가지는 경우:중심 원자에 결합된 원자 수와 비공유 전자쌍의 수에 따라 분자의 모양이 달라진다.
- 중심 원자가 3개의 원자와 결합하고, 중심 원자의 비공유 전자쌍 수가 1일 경우:삼각뿔형
⇨ 4개의 전자쌍은 중심 원자 주위에 사면체 형태로 배열된다. 비공유 전자쌍과 공유 전자쌍 사이의 반발력이 공유 전자쌍 사이의 반발력보다 크므로 결합각은 정사면체일 때보다 작아지고, 분자 모양은 삼각뿔형이 된다.
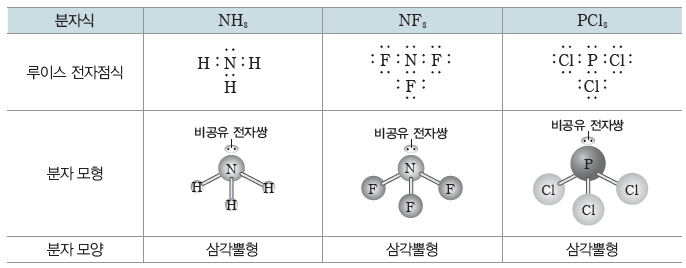
- 중심 원자가 2개의 원자와 결합하고, 중심 원자의 비공유 전자쌍 수가 2일 경우:굽은 형
⇨ 4개의 전자쌍은 중심 원자 주위에 사면체 형태로 배열된다. 비공유 전자쌍 사이의 반발력이 크므로 결합각은 더욱 작아지고, 분자 모양은 굽은 형이 된다.
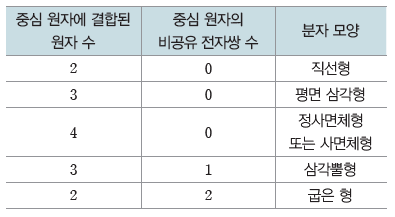
(4) 분자 모양의 예측
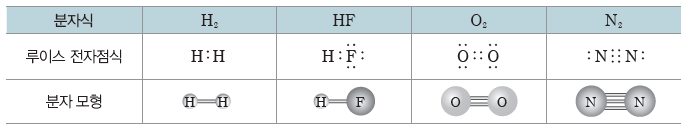
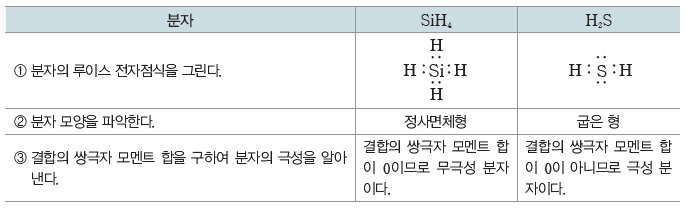
① 분자의 루이스 전자점식을 그린다.
② 중심 원자에 결합된 원자 수와 비공유 전자쌍 수를 세어 본다.
③ 전자쌍 반발 이론을 이용하여 중심 원자의 전자쌍 배열을 결정한다.
④ 원자의 위치와 결합각을 고려하여 분자 모양을 예측한다.
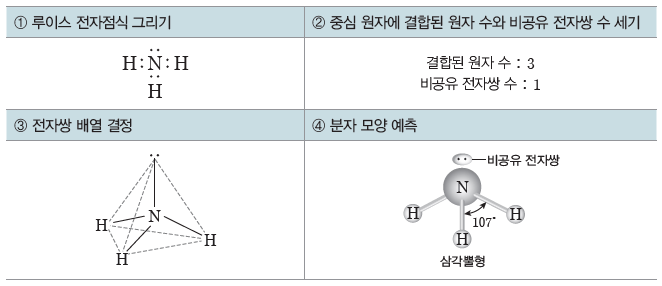
예) 암모니아(NH3)의 분자 모양 예측
분자의 성질
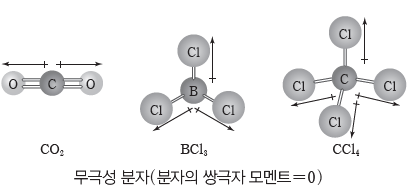
(1) 무극성 분자
① 무극성 공유 결합이 있는 이원자 분자는 모두 무극성 분자이다.
예) H2, Cl2, O2 등
② 극성 공유 결합이 있는 분자라도 각 결합의 쌍극자 모멘트 합이 0인 분자 모양이면 분자의 쌍극자 모멘트가 0이므로 무극성 분자이다.
예)
(2) 극성 분자:극성 공유 결합이 있는 분자 중에서 각 결합의 쌍극자 모멘트 합이 0이 아닌 분자 모양이면 분자의 쌍극자 모멘트가 0이 아니므로 극성 분자이다.
예)

(3) 분자의 극성 알아내기
(4) 무극성 분자와 극성 분자의 성질
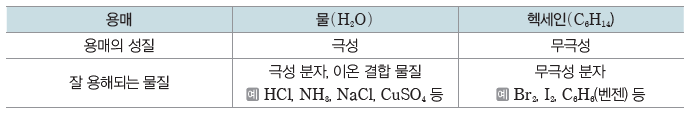
① 용해성
- 극성 분자는 극성 용매에 잘 용해되고, 무극성 분자는 무극성 용매에 잘 용해된다.
- 극성 용매와 무극성 용매는 서로 잘 섞이지 않고 층을 이룬다.
예) 무극성 물질인 아이오딘(I2)은 극성 용매인 물(H2O)에는 잘 용해되지 않지만, 무극성 용매인 헥세인(C6H14)에는 잘 용해된다.
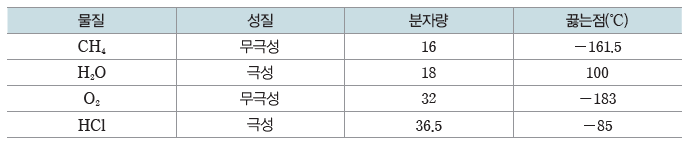
② 끓는점
- 극성 물질은 분자에서 부분적인 양전하(δ+)를 띤 원자와 이웃한 분자의 부분적인 음전하(δ–)를 띤 원자 사이에 인력이 존재하므로 분자량이 비슷한 무극성 물질에 비해 분자 사이의 인력이 크다.
- 일반적으로 극성 물질은 분자량이 비슷한 무극성 물질보다 끓는점이 높다.
예) CH4과 H2O은 분자량이 비슷하지만 끓는점은 극성 물질인 H4O이 무극성 물질인 CH4보다 높다.
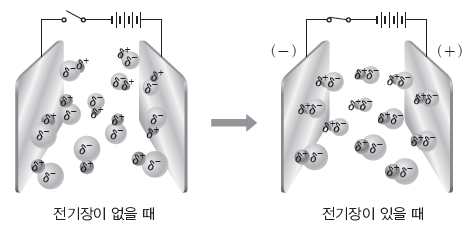
③ 전기적 성질:극성 분자는 분자의 쌍극자 모멘트가 0이 아니므로 전기장에서 기체 상태의 극성 분자는 부분적인 음전하(δ–)를 띠는 부분이 전기장의 (+)극 쪽으로, 부분적인 양전하(δ+)를 띠는 부분이 전기장의 (-)극 쪽으로 향하도록 배열된다.