원자의 구성 입자
(1) 전자의 발견
① 음극선:진공관 안에 전극을 연결하여 높은 전압을 걸어 주면 (-)극에서 (+)극으로 빛의 흐름이 나타나는데, 이를 음극선이라고 한다.
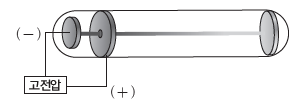
② 음극선 실험:1897년 톰슨은 음극선에 대한 몇 가지 실험 결과를 통해 음극선이 질량을 가지며 (-)전하를 띤 입자의 흐름임을 알아내었다. (-)극으로 사용한 금속의 종류와 방전관에 들어 있는 기체의 종류에 관계없이 음극선이 같은 특성을 보이므로 음극선의 구성 입자가 모든 물질의 공통적인 입자라고 생각하였고, 이를 전자라고 하였다.
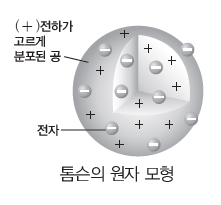
③ 톰슨의 원자 모형:톰슨은 음극선 실험을 통해 원자가 (-)전하를 띠는 입자인 전자를 포함하고 있음을 확인하였고, (+)전하가 고르게 분포된 공 속에 (-)전하를 띤 전자가 박혀 있는 원자 모형을 제안하였다.
(2) 원자핵의 발견
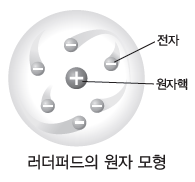
① a 입자 산란 실험:1911년 러더퍼드는 금박에 (+)전하를 띤 a 입자를 충돌시키는 실험을한 결과, 대부분의 a 입자는 금박을 그대로 통과하지만 극히 일부의 a 입자가 크게 휘어지거나 튕겨 나오는 현상을 관찰하게 되었다. 이를 바탕으로 원자의 대부분이 빈 공간이며 원자의 중심에 원자 질량의 대부분을 차지하면서 크기가 매우 작고 (+)전하를 띤 입자가 있음을 발견하였고, 이를 원자핵이라고 하였다.
② 러더퍼드의 원자 모형:원자핵을 발견한 러더퍼드는 (+)전하를 띠는 매우 작은 크기의 원자핵이 원자의 중심에 있고, (-)전하를 띠는 전자가 원자핵 주위를 돌고 있는 원자 모형을 제안하였다.
(3) 원자를 구성하는 입자
① 원자의 구조 : 원자는 물질을 구성하는 기본 입자로, 원자의 중심에 (+)전하를 띠는 원자핵이 있고, 원자핵 주위에 (-)전하를 띠는 전자가 위치한다. 원자핵은 양성자와 중성자로 이루어져 있다.
② 원자를 구성하는 입자의 성질
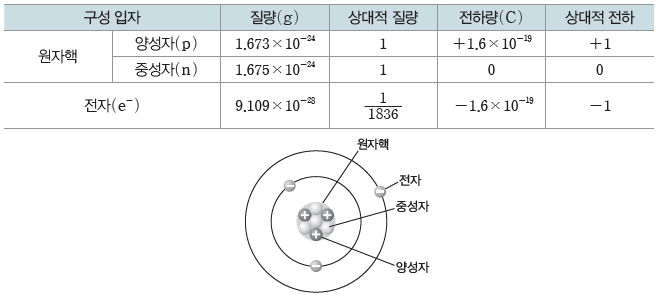
- 양성자(p):중성자와 함께 원자핵을 구성하는 입자로, 원소에 따라 그 수가 다르다. 같은 원소의 원자는 양성자수가 같으며, 원자를 구성하는 양성자수가 그 원소의 원자 번호이다.
- 중성자(n):양성자와 질량이 거의 같으며 전하를 띠지 않는 입자로 양성자와 함께 원자핵을 구성한다. 같은 원소의 원자라도 중성자수는 다를 수 있다.
- 전자(e–):양성자와 전하량의 크기는 같고 부호는 반대인 (-)전하를 띠는 입자로, 질량
은 양성자 질량의 1/1836배 정도이다.
- 양성자와 전자는 전하량의 크기는 같지만 전하의 부호가 서로 반대이며, 원자에서 양성자 수와 전자 수는 같으므로 원자는 전기적으로 중성이다.
(4) 원자의 표시
① 원자 번호:원자의 종류는 원자핵 속 양성자수에 따라 달라지므로 원자 번호는 양성자수로정하며, 원소 기호의 왼쪽 아래에 표시한다. 전기적으로 중성인 원자는 양성자수와 전자 수가 같다.

② 질량수:원자핵을 구성하는 양성자수와 중성자수를 합한 수를 질량수라고 한다. 질량수는원소 기호의 왼쪽 위에 표시한다.

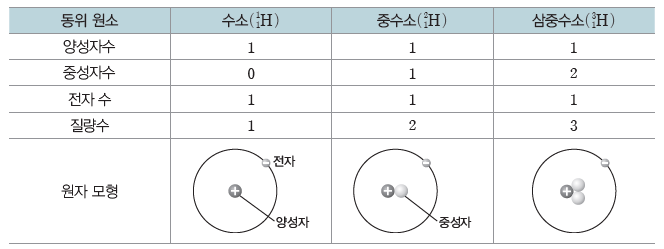
동위 원소
(1) 동위 원소
양성자수가 같아 원자 번호는 같으나 중성자수가 달라 질량수가 다른 원소로, 질량수가 클수록 더 무겁다. 동위 원소는 화학적 성질은 거의 같으나, 질량이 다르므로 물리적 성질은 다르다.
예) 수소(H)의 동위 원소
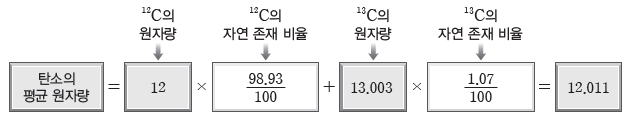
(2) 평균 원자량
① 평균 원자량:자연계에 존재하는 동위 원소의 존재 비율을 고려하여 평균값으로 나타낸 원자량이다.
② 평균 원자량을 구하는 방법:자연계에 존재하는 모든 동위 원소의 (동위 원소의 원자량_동위 원소의 존재 비율)의 합으로 계산한다.
예) 탄소(C)의 평균 원자량 구하기:원자량이 12인 12C의 자연 존재 비율은 98.93%이고, 원자량이 13.003인 13C의 자연 존재 비율은 1.07%이다.
참고자료: EBS 수능특강 화학1
