화학 반응식
(1) 화학 반응식
화학식과 기호를 사용하여 화학 반응을 나타낸 식이다.
① 화살표(→)의 왼쪽에 반응물, 오른쪽에 생성물을 표기한다.
② 화학식 뒤에 물질의 상태를 ( ) 안에 써서 나타내기도 한다.
예) 고체:(s), 액체:(l), 기체:(g), 수용액:(aq)
(2) 화학 반응식 만들기
반응물과 생성물에 있는 원자의 종류와 개수가 같도록 계수를 맞춘다. 이때 계수는 일반적으로 가장 간단한 자연수비로 나타내고, 1이면 생략한다.
예) 수소와 산소가 반응하여 수증기를 생성하는 반응의 화학 반응식 만들기
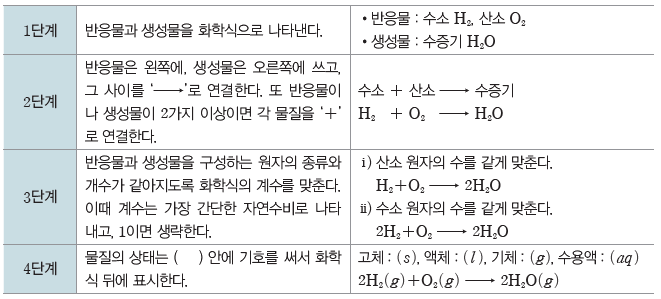
(3) 화학 반응식의 의미
화학 반응식을 통해 반응물과 생성물의 종류를 알 수 있고, 물질의 양(mol), 분자 수, 질량, 기체의 부피 등의 양적 관계를 파악할 수 있다.
① 화학 반응식의 계수비는 반응 몰비 및 반응 분자 수비와 같다.
② 기체인 경우, 일정한 온도와 압력에서 화학 반응식의 계수비는 기체의 반응 부피비와 같다.
③ 반응물의 질량 총합과 생성물의 질량 총합은 같지만 반응 질량비는 화학 반응식의 계수비와 같지 않다.

예) 질소와 수소가 반응하여 암모니아가 생성되는 반응의 화학 반응식은
N2(g)+3H2(g) → 2NH3(g)이다.
- 계수비는 N2 : H2 : NH3=1 : 3 : 2이다.
- 반응 몰비와 반응 분자 수비는 N2 : H2 : NH3=1 : 3 : 2이다.
- 일정한 온도와 압력에서 기체의 반응 부피비는 N2 : H2 : NH3=1 : 3 : 2이다.
- 반응 질량비는 N2 : H2 : NH3=14 : 3 : 17이다.
화학 반응에서의 양적 관계
화학 반응에서 반응물과 생성물의 계수비가 반응 몰비와 같다는 것을 이용하여 반응물과 생성물의 질량이나 부피를 구할 수 있다.
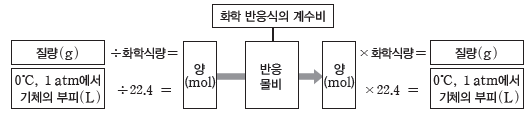
(1) 화학 반응에서의 질량·질량 관계
화학 반응식에서 각 물질의 계수비는 반응 몰비와 같다. 화학 반응에서 물질의 양(mol)과 질량의 관계를 이용하면 반응물과 생성물 중 어느 한 물질의 질량만 알아도 다른 물질의 질량을 구할 수 있다.
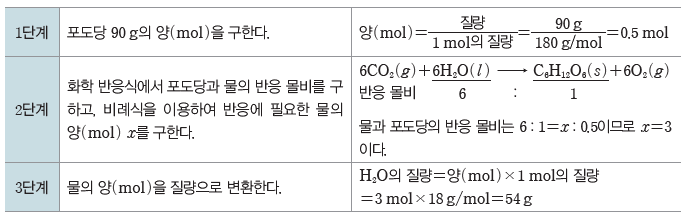
예) 포도당(C6H12O6) 90 g이 생성되는 데 필요한 물(H2O)의 질량 구하기
화학 반응식:6CO2(g)+6H2O(l) → C6H12O6(s)+6O2(g)
(2) 화학 반응에서 기체의 부피·부피 관계
반응물과 생성물이 기체인 경우 화학 반응식에서 각 물질의 계수비는 기체의 반응 부피비와 같다. 이를 이용하면 일정한 온도와 압력에서 반응물과 생성물 중 어느 한 기체의 부피만 알아도 다른 기체의 부피를 구할 수 있다.
예) 일정한 온도와 압력에서 암모니아(NH3) 30 L가 생성되는 데 필요한 수소(H2)의 부피 구하기
화학 반응식 : N2(g)+3H2(g) → 2NH3(g)

(3) 화학 반응에서의 질량·부피 관계
화학 반응식에서 각 물질의 계수비는 반응 몰비와 같다. 일정한 온도와 압력에서 기체 1 mol의 부피를 알 때 반응물과 생성물 중 어느 한 물질의 질량이나 부피만 알아도 다른 물질의 질량이나 부피를 구할 수 있다.
예) 알루미늄(Al) 5.4 g과 충분한 양의 염산(HCl(aq))이 반응할 때 생성되는 수소(H2)의 0℃, 1 atm에서의 부피 구하기
화학 반응식 : 2Al(s)+6HCl(aq) → 2AlCl3(aq)+3H2(g)
용액의 농도
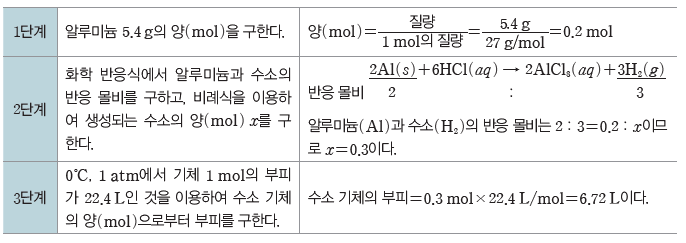
(1) 용해와 용액
① 용해:용질이 용매와 고르게 섞이는 현상이다.
② 용액:두 종류 이상의 순물질이 균일하게 섞여 있는 혼합물을 용액이라고 하며 용액에서 녹이는 물질을 용매, 녹는 물질을 용질이라고 한다.
③ 용액의 농도:용액이 얼마나 진하고 묽은지를 나타내는 값이며, 퍼센트 농도(%), 몰 농도(M) 등이 있다.
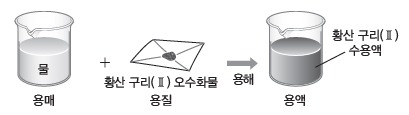
(2) 퍼센트 농도
용액 100 g에 녹아 있는 용질의 질량(g)을 나타내며, 단위는 %를 사용한다.
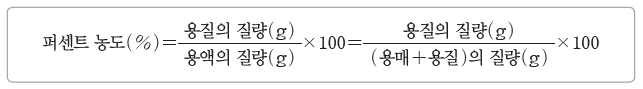
① 퍼센트 농도와 용액의 질량을 알면 용액에 녹아 있는 용질의 질량을 구할 수 있다.

예) 15% 포도당 수용액 200 g에 들어 있는 물과 포도당의 질량
⇨ 용질의 질량(g)=용액의 질량(g)×퍼센트 농도(%)/100 이므로
포도당의 질량(g)=200 g×15/100=30 g이다.
⇨ 15% 포도당 수용액 200 g은 물 170 g과 포도당 30 g이 혼합된 수용액이다.
② 용액과 용질의 질량으로 나타내므로 온도나 압력의 영향을 받지 않는다.
몰 농도
(1) 몰 농도
용액 1 L 속에 녹아 있는 용질의 양(mol)으로 나타낸 농도이며, 단위는 M 또는 mol/L를 사용한다.

① 용액의 부피를 기준으로 하기 때문에 사용하기에 편리하다.
② 온도에 따라 용질의 양(mol)은 변하지 않지만 용액의 부피가 변하므로 몰 농도는 온도에 따라 달라진다.
③ 용액의 몰 농도와 부피를 알면 녹아 있는 용질의 양(mol)을 구할 수 있다.

(2) 용액 만들기
특정한 몰 농도의 용액을 만들 때 부피 플라스크, 전자저울, 비커, 씻기병 등이 필요하다.
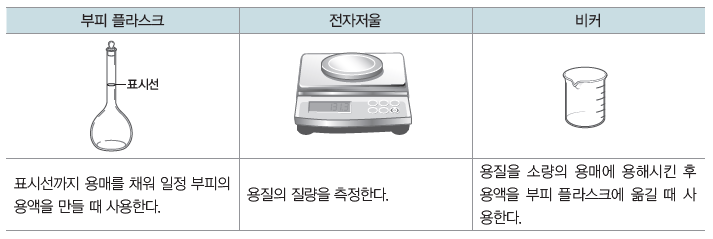
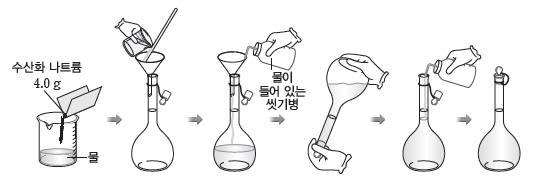
예 0.1 M 수산화 나트륨(NaOH) 수용액 1 L 만들기
❶ 화학식량이 40인 NaOH 4.0 g을 적당량의 물이 들어 있는 비커에 넣어 모두 녹인다.
❷ 1 L 부피 플라스크에 ❶의 용액을 넣는다.
❸ 물로 비커를 씻어 묻어 있는 용액까지 부피 플라스크에 넣는다.
❹ 부피 플라스크에 물을 2/3 정도 넣고, 용액을 섞는다.
❺ 표시선까지 물을 가하고, 용액을 충분히 흔들어 준다.
❻ 실온으로 식힌 후 다시 표시선까지 물을 채운다.
(3) 용액의 희석과 혼합
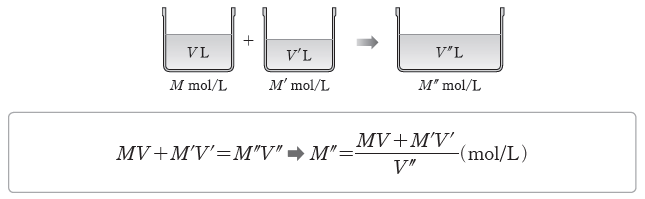
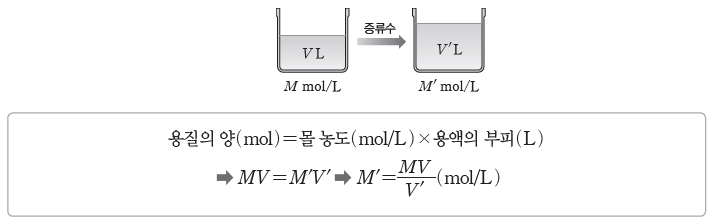
① 용액 희석하기:어떤 용액에 물을 가하여 용액을 희석했을 때 용액의 부피와 몰 농도는 달라지지만 그 속에 녹아 있는 용질의 양(mol)은 변하지 않는다.
- 용액의 몰 농도가 M mol/L인 용액 V L에 물을 가하여 몰 농도는 M’ mol/L, 부피는 V’ L가 되었다면 두 용액에서 용질의 양(mol)은 같으므로 다음 관계가 성립한다.
예) 0.1 M 포도당 수용액을 희석하여 0.01 M 포도당 수용액 500 mL 만들기
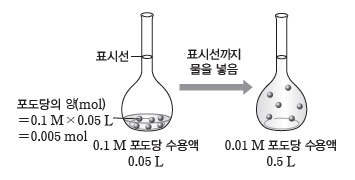
❶ 용액을 희석해도 그 속에 녹아 있는 용질의 양(mol)은 변하지 않으므로, 희석된 용액에 녹아 있는 포도당의 양(mol)을 계산한다.
⇨ 0.01 M 포도당 수용액 0.5 L에 녹아 있는 포도당의 양(mol)은 몰 농도×부피
=0.01 M×0.5 L=0.005 mol이다.
❷ 진한 용액에서 같은 양(mol)의 포도당을 얻는 데 필요한 부피를 계산한다.
⇨ 용액의 부피(L)= 용질의 양(mol)/몰 농도(mol/L)=0.005 mol/0.1 mol/L=0.05 L이므로 0.1 M 포도당 수용액 0.05 L가 필요하다.
❸ 0.1 M 포도당 수용액 0.05 L를 500 mL 부피 플라스크에 넣고 표시선까지 물을 채워 용액의 부피를 500 mL로 맞춘다.
② 혼합 용액의 몰 농도:몰 농도가 서로 다른 두 용액을 혼합하면 용액의 부피와 몰 농도는 달라지지만 혼합 용액에 녹아 있는 용질의 양(mol)은 혼합 전 각 용액에 녹아 있는 용질의 양
(mol)의 합과 같다.
- 용액의 몰 농도가 M mol/L인 용액 V L에 M’ mol/L인 용액 V’ L를 혼합하여 용액의 몰 농도가 M” mol/L, 용액의 전체 부피가 V” L가 되었다면 다음 관계가 성립한다.